下列反应的离子方程式书写正确的是
| A.将溶质物质的量之比为2∶7的三氯化铝溶液和氢氧化钡溶液混合 2Al3+ + 7OH- = Al(OH)3 ↓ + AlO2- + 2H2O |
| B.将溶质物质的量之比为4∶3的 硫酸氢钠和氢氧化钡溶液两溶液混合: 4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O |
| C.用石墨电极电解碘化镁溶液 2 I- - 2 e- =" I" 2 |
| D.将16.8g铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO) |
6Fe + 20 H++ 5NO3- = 3Fe2+ + 3Fe3+ + 5NO↑ +10H2O
下列物质中, 酸性最弱的是()
| A.碳酸 | B.硅酸 | C.硫酸 | D.高氯酸 |
甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系:
满足条件的甲和乙为()
| A.碳和铜 | B.氟和氧 | C.碳和氢 | D.碳和硅 |
下列离子方程式书写不正确的是()
| A.大理石跟盐酸反应:CaCO3+2H+====Ca2++H2O+CO2↑ |
| B.石灰水中通入CO2:CO2+Ca2++2OH-====CaCO3↓+H2O |
| C.在水玻璃(Na2SiO3)溶液中加入盐酸:Na2SiO3+2H+====H2SiO3↓+2Na+ |
D.二氧化硅与烧碱溶液反应:SiO2+2OH-====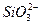 +H2O +H2O |
下列各组物质相互作用时,水既不作氧化剂,又不作还原剂,且反应属于氧化还原反应的是()
| A.氟与水 | B.硅与强碱溶液 | C.氯气与水 | D.SO2与水 |
德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示),下列有关C20的说法不正确的是()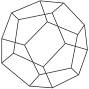
| A.C20与C60、C70互为同素异形体 | B.C20中有12个五边形,30条棱边 |
| C.C20具有很高的硬度和熔沸点 | D.C20的摩尔质量是240 g·mol-1 |