长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:①称量a g样品,置于烧杯中。②加入适量蒸馏水,使样品溶解。③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。④过滤,用蒸馏水洗涤沉淀。⑤加热干燥沉淀物。⑥将沉淀物冷却至室温后,称量。⑦重复⑤⑥操作直到合格,最后得到b g固体。
完成下列问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?_____________。其理由是_____________。
(2)步骤③中加盐酸使溶液呈现强酸性的目的为_____________________。
(3)步骤⑦“合格”的标准是___________________________________。
(4)实验测得样品中无水亚硫酸钠的质量分数是_______________。(列出算式,不需化简)
混有食盐杂质的明矾样品,为求明矾的质量分数,称取样品3.00g,溶于适量蒸馏水中,再加入足量氯化钡溶液,充分反应后,过滤、洗涤、干燥,得干燥的固体2.33g,求样品中明矾的质量分数。
与水的离子积Kw=[H+]·[OH-]相似,FeS饱和溶液中也有离了积KSP=[Fe2+]·[S2-]。已知t℃时FeS的KSP=6.25×10-18,则t℃时饱和FeS溶液的物质的量浓度为____。又知t℃时H2S饱和溶液中[H+]2[S2-]=1.0×10-22,现将适量FeS投入H2S饱和溶液中要使[Fe2+]达到1mol·L-1,则应将溶液的pH调节到____。如已知CuS的离子积KSP=9.1×10-36,现将适量CuS放入H2S饱和溶液中,要使[Cu2+]达到0.01 mol·L-1时,应使该溶液的[H+]达到____。由此说明CuS在一般酸中能否溶解?
在500 g CuSO4溶液中插入两根电极,一根为铁,一根为含杂质锌均匀的粗铜。通电一段时间后切断电源,立即将电极取出,这时铁极上析出7.04 g铜,电解质溶液增重0.02 g。求粗铜中含锌的质量分数。
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液中Cu2+的浓度。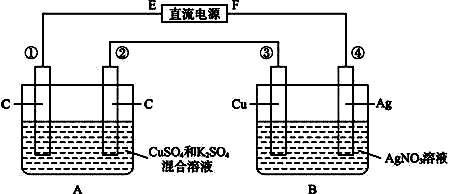
如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
(1)当以I=0.21A的电流电解60分钟后,测得铜片A的质量增加了0.25g,则如图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________(选填“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电荷量e-=1.60×10-19C)