如图所示为实验室制SO2并验证SO2的某些性质的装置图。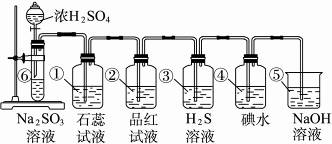
试完成下列问题:
(1)⑥中反应的化学方程式为_____________。
(2)①中的实验现象为_____________,此实验证明SO2是_____________气体。
(3)②中的品红溶液_____________,证明SO2有_____________性。
(4)③中的实验现象是_____________,证明SO2有_____________性。
(5)④中的实验现象是_____________,证明SO2有_____________性。
(6)⑤的作用是_____________,反应的化学方程式是__________________________。
如图所示装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2—3种;硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。
请完成下列问题:
(1)气体X的化学式是____________。
(2)所选药品a是____________,b是____________,装置B的作用是____________。
(3)用所选的药品发生反应生成X时,离子方程式是___________________________。
(4)反应刚开始时A中的主要现象是____________。
下图是铜与稀硝酸反应的两个实验装置图,请完成下列问题:
(1)铜与稀硝酸反应的离子方程式:____________________________________________。
(2)Ⅰ实验装置中能否证明铜与稀硝酸反应生成的是NO气体____________(填“能”或“不能”),简述理由_______________________________________________________________。
(3)若用Ⅱ实验装置进行实验,证明铜与稀硝酸反应生成的气体是NO,则:检查装置气密性的操作是________________________;在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_______________________;反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是_____________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是_________________。
根据下图完成下列问题。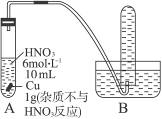
(1)A中发生反应的化学方程式:_______________________________________________。
(2)依次写出从反应开始到结束,A中可以观察到的现象:_________________________。
(3)反应结束后共收集到224 mL标准状况下的NO,计算Cu的纯度:_______________。
(12分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物
是
(2)现提供以下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号
及实验中观察到的现象:
| 同学正确 |
选用试剂 |
实验现象 |
| 第一种方法 |
||
| 第二种方法 |
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?
理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
(1)从以下仪器中选出所需仪器(用字母填写)。
(A)托盘天平;(B)研钵;(C)试管夹;(D)酒精灯;(E)蒸发皿;(F)玻璃棒;(G)坩埚;(H)干燥器;(I)泥三角;(J)石棉网;(K)三角架;(L)药匙;(M)坩埚钳。
(2)实验后得到以下数据:
①加热前质量:W1(容器)=5.4g;W2(容器十晶体)=7.9g;
②加热后质量:W3(容器十无水硫酸铜)=6.8g。
请写出结晶水含量——质量分数的计算式(用Wl、W2、W3表示):______这一结果是偏高还是偏低?_______。
从下列分析中选出造成实验误差的原因可能是(填写字母)________。
A.加热前称量时容器未完全干燥 B.最后两次加热后质量相差较大(>0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失