(12分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物
是
(2)现提供以下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号
及实验中观察到的现象:
| 同学正确 |
选用试剂 |
实验现象 |
| 第一种方法 |
|
|
| 第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?
理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验 序号 |
燃烧有机物的质量 |
① |
② |
||
| 实验前 质量 |
实验后 质量 |
实验前 质量 |
实验后 质量 |
||
| 1 |
m1 |
m2 |
m3 |
m4 |
m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式,与该有机物相对分子质量相同的烃的一氯代物有种。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程为:,检验是否有Fe2+应选用下列(选填序号)试剂。
A.KSCN溶液和氯水B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况下)气体Y通入足量溴水中,可以发生:SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1是相对分子质量最小的气体,在标准状况下,密度为0.0893g·L-1,Q2是空气的成份之一。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。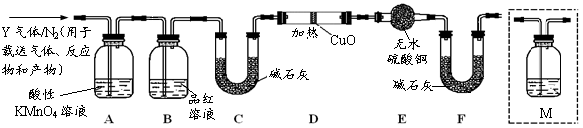
(3)装置B中试剂的作用是;
(4)用化学方程式表示Y气体中的Q2气体是如何生成的:;
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
A.A之前B.A-B间 C.B-C间D.C-D间
(12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
(14分) 孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验: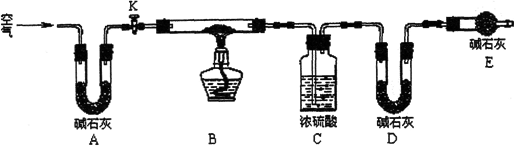
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于硬直玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________ (请补充该步操作内容)。
步骤5:冷却至室温,称量相关装置的质量。
(1)孔雀石热分解的化学方程式_____________________________。
(2)装置A的作用是__________________;若无装置E,则实验测定的x/y的值将__________(选填“偏大”、“偏小”或“无影响”)。
(3)某同学在实验过程中采集了如下数据:
| A.反应前玻璃管与样品的质量163.8g |
| B.反应后玻璃管中残留固体质量20g |
| C.装置C实验后增重2.25g |
| D.装置D实验后增重5.5g |
为测定x/y的值,你认为可以选用上述所采集数据中的_________________
(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式________。
(16分)某学习小组拟以下列合成路线合成1﹣丁醇:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO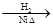 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:①HCOOH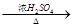 CO↑+H2O(HCOOH还原性强) ②RCH=CH2
CO↑+H2O(HCOOH还原性强) ②RCH=CH2 RCOOH+CO2+H2O
RCOOH+CO2+H2O
请填写下列空白: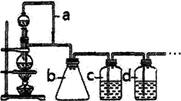
(1)利用如图装置可以制备纯净干燥的CO,则a装置的作用是______________,若无b装置可能产生的后果是________, c装置中发生反应的离子方程式为_______________________________
(2)以2-丙醇为原料可以制备丙烯,化学反应方程式__________________________
在所得丙烯气体中还含有少量SO2、CO2及水蒸气。用以下试剂可以检验四种气体,则混合气体通过试剂的顺序依次是________________(填序号)。
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水:④无水CuSO4;⑤品红溶液
(3)正丁醛经催化加氢得到含少量正丁醛的1﹣丁醇粗品。为提纯1﹣丁醇,该小组设计出如下提纯路线:
已知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓:
②沸点:乙醚34℃,1-丁醇:118℃。
则操作1为___________,操作2为_____________,操作3为___________。