(16分)某学习小组拟以下列合成路线合成1﹣丁醇:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO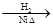 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:①HCOOH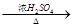 CO↑+H2O(HCOOH还原性强) ②RCH=CH2
CO↑+H2O(HCOOH还原性强) ②RCH=CH2 RCOOH+CO2+H2O
RCOOH+CO2+H2O
请填写下列空白: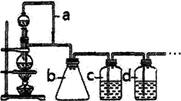
(1)利用如图装置可以制备纯净干燥的CO,则a装置的作用是______________,若无b装置可能产生的后果是________, c装置中发生反应的离子方程式为_______________________________
(2)以2-丙醇为原料可以制备丙烯,化学反应方程式__________________________
在所得丙烯气体中还含有少量SO2、CO2及水蒸气。用以下试剂可以检验四种气体,则混合气体通过试剂的顺序依次是________________(填序号)。
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水:④无水CuSO4;⑤品红溶液
(3)正丁醛经催化加氢得到含少量正丁醛的1﹣丁醇粗品。为提纯1﹣丁醇,该小组设计出如下提纯路线:
已知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓:
②沸点:乙醚34℃,1-丁醇:118℃。
则操作1为___________,操作2为_____________,操作3为___________。
(15分)高锰酸钾[KMnO4]是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾[K2MnO4]。下图是实验室模拟制备的操作流程:
相关资料:
①物质溶解度
| 物质 |
KMnO4 |
K2CO3 |
KHCO3网] |
K2SO4 |
CH3COOK |
| 20℃溶解度 |
6.4 |
111 |
33.7 |
11.1 |
217 |
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 :;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程为_________;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
图中A口加入的溶液最好为__________。
使用阳离子交换膜可以提高Mn元素利用率的原因为_______________。
(14分)铝热反应是铝的一个重要性质。某校化学兴趣小组同学,取磁性氧化铁在如图实验装置进行铝热反应,冷却后得到“铁块”混合物。
(1)取反应后的“铁块”研碎取样称量,加入如图装置滴入足量NaOH溶液充分反应,测量生成气体体积。试回答下列问题:
①该实验的实验目的是:测量样品中的百分含量(填物质名称)。
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为。
③量气管在读数时调节左右管液面相平之前的步骤是________ _。
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用。如果装置使用分液漏斗,测量出的该物质百分含量将会(填“偏大”或“偏小”)。
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
|
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
①试剂A应选择,试剂B应选择。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②灼烧完全的标志是。
③若最终红色粉未M的质量为12.0 g,则该“铁块”中铁的百分含量是。
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是,植物粉的作用是。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下: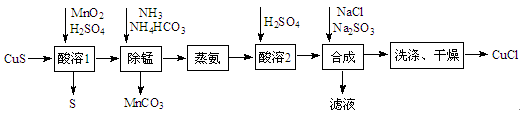
(1)酸溶1步骤中加入MnO2的作用是。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为。
(6)洗涤步骤先用洗,再用无水乙醇洗涤。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
存在Fe3+ |
|
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴(填序号)溶液,振荡 |
存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是。
(3)经小组讨论并验证该无色气体为O2,其操作方法是。
(4)【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为。
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为。