(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。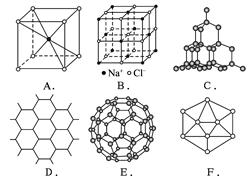
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+
和Cl-的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C60、金刚石和石墨三者的关系是_______________。
| A.同分异构体 | B.同素异形体 | C.同系物 | D.同位素 |
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C60结构形如足球,如E图,则C60中有_______________个六边形,_______________个五边形。固态时,C60属于_______________ (填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。
已知:一个碳原子上连有两个羟基时,易发生下列转化:



请根据下图作答(图中无机产物均省去):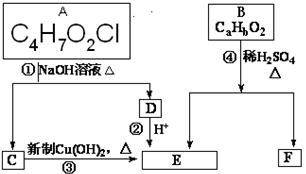
C中含有的官能团的名称是________________。
③反应类型为。
D的结构简式为_________________________。
(2) 写出反应①化学方程式
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O)=2:1,则B的化学式为_______________________________。
(4)若F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应:③苯环上的一氯代物只有两种。则F在一定条件下发生加聚反应的化学方程式为_____________。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有种结构,写出其中一种的结构简式______________________。
饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。


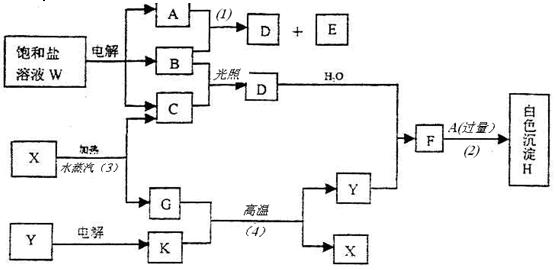
回答下列问题:


①W的名称是,G的俗名是。
②A分子的空间构型是,键角是°′。
③反应(3)的化学方程式是。
反应(4)的化学方程式是。
④饱和盐溶液W电解的离子方程式是。
⑤已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式。
下表为元素周期表的短周期部分。请填空。(注意:答题时,各元素均用推断出的元素符号表示。)
| A |
D |
E |
|||||
| G |
J |
L |
(1)写出A22- 的电子式,分子EAD 的结构式
G、J、L三种元素形成的简单离子中,半径由大到小的顺序是__________。(用离子符号表示)

(2)A元素可形成化合物Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(AO)5晶体属于(填晶体类型)。
(3)化合物GD在一定条件下与足量的J的最高价氧化物对应水化物发生反应,写出该反应的化学方程式;
(4)L2 与 (AD)2化学性质相似,写出 (AD)2 与 NaOH溶液反应的离子方程式


(5) M与E同主族且比E多三个电子层,M位于元素周期表第______周期______族,有研究显示HMO具有两性,则HMO与盐酸反应化学方程式为
_。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为_____________ ;
(2)漂白粉的有效成分是(填化学式)_________________;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_______________________________ ;
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。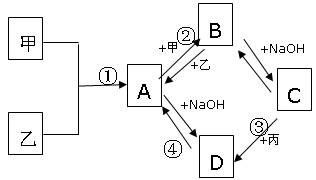
(1)写出下列物质的化学式;乙___________ ;B ___________。
(2)写出③反应的化学方程式:____________________ 。
(3)写出②反应的离子方程式:_______________________ 。