周期表中有些元素有“隔类相似”现象(即对角线相似),如Mg与Li;Si和B;Be和Al等,现用熔融LiCl电解可得锂和氯气,若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电
极电解。结果得到金属锂和一种无色无味气体,其主要理由是( )
| A.电解出的锂和水反应放出氢气 |
| B.电解前LiCl在加热时水解 |
| C.电解时产生的无色气体是氯气 |
| D.在高温时阳极放出氯气与水作用释氧 |
下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
检验水解产物中的氯离子 |
| B |
乙醇与浓硫酸加热170℃,将所产生的气体通入溴水中 |
确定是否有乙烯生成 |
| C |
向工业酒精中加入无水硫酸铜 |
确定工业酒精中是否含有水 |
| D |
电石与水反应,制得的气体直接通人酸性KMnO4溶液 |
检验制得的气体是否为乙炔 |
已知卤代烃可以跟金属钠反应生成碳链较长的烃,如:CH3Cl + 2Na + CH3Cl → CH3—CH3 + 2NaCl,现有CH3CH2Br和CH3—CHBr—CH3的混合物与金属钠反应后,不可能得到的烃是 ()
| A.2—甲基丁烷 | B.2—甲基戊烷 | C.2,3—二甲基丁烷 | D.丁烷 |
下列实验可达到实验目的的是()
A.将 与NaOH的醇溶液共热制备CH3—CH=CH2 与NaOH的醇溶液共热制备CH3—CH=CH2 |
B.乙酰水杨酸 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备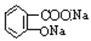 |
| C.向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D.苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
下列说法正确的是( )
| A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n |
| B.一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积 |
| C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100 ℃),则y=4;若体积减小,则y>4;否则y<4。 |
| D.相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高 |
下列各组物质中不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是()
| A.乙炔和乙烯 | B.乙醇和丙醇 |
| C.乙醇和乙醚(C2H5OC2H5) | D.甲醛(HCHO)和乙酸 |