(8分) 在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(g)+2Y(g)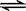 3Z(g),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(g),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)上述平衡中X的百分含量为 ;
(2)相同实验条件下,在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 mol;
(3)相同实验条件下,在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol;
(4)相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
(7分)海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。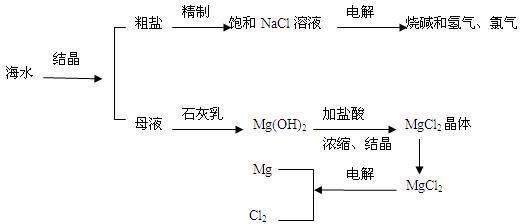
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液。精制时通常向精盐溶液中依次加入过量的BaCl2溶液,过量的NaOH溶液和过量的Na2CO3溶液,过滤出沉淀后再向滤液加入盐酸至溶液呈中性。请写出下列操作中有关化学反应的离子方程式:
①向溶液中加入过量的Na2CO3溶液:__________________、_____________________;
②电解氯化钠溶液:______________________________________________。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可以看出,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:(用离子反应方程式回答)___________________________。
②简述怎样操作才能由氯化镁晶体得到无水氯化镁:____________________________。
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表,第 族,区,
(2)Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+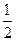 O2(g)=XO2(g)
O2(g)=XO2(g) H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
Y(g)+ O2(g)=YO2(g) H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
已知有下图所示物质相互转换关系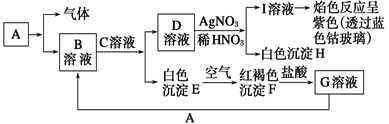
试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的现象 ;其发生反应的化学方程式________。
(3)鉴别B溶液中阳离子的操作方法及实验现象__________________;
(4)向G溶液中加入A的离子方程式________
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO、CO中的一种或几种,取此溶液做下列实验:①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断: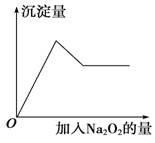
(1)溶液中一定含有的离子是______________ 。
(2)溶液中肯定不含有的离子是________________ 。
(3)可能含有的离子是____________ 。
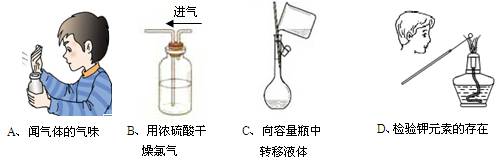
下列实验装置图的实验操作,不能达到相应的实验目的是