有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的最外层电子数是次外层电子数的两倍;C的单质燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质反应,可以得到与D单质颜色相同的固态化合物甲;D的最高价与最低价代数和为其最低价绝对值的两倍。据此,回答下列问题:
(1)写出A与B两元素所形成化合物AB2的电子式__________,该化合物分子属于
分子(极性或非极性)。
(2)用电子式表示形成C2D的形成过程: 。
(3)C、D两元素还可以形成化合物C2D2,该化合物性质类似于C2B2,试写出C2D2与稀盐酸反应的化学方程式 。
关于化学反应热效应的叙述中,正确的是( )
| A.放热反应在常温下就一定很容易发生 | B.放热反应中反应物的总能量大于生成物的总能量 |
| C.化学反应过程中,化学能一定转化成热能 | |
| D.凡是需加热才能进行的反应—定是吸热反应 |
下列化学式既能表示物质的组成,又能表示物质的一个分子的是()
| A.NaOH | B.SiO2 | C.Fe | D.CO2 |
a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是





 ()
()

A.常温下,a能从水中置换出氢,而b不能 |
B.原子的电子层数a比b多 |
C.原子的最外层电子数a比b少 |
D.1 mol a 、b分别与足量盐酸反应,生成H2的质量a比b大 |
不能用来区别甲烷和乙烯的是()
| A.酸性高锰酸钾溶液 | B.溴水 |
C.溴的四氯化碳溶液 | D.H2 |
在密闭容器中进行反应2SO2 + O2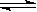 2SO3,反应达平衡的标志是()
2SO3,反应达平衡的标志是()
 ①单位时间内消耗2 mol SO2 的同时生成2 mol SO3
①单位时间内消耗2 mol SO2 的同时生成2 mol SO3 ②反应混合物中,SO2、O2 与SO3 的物质的量之比为2∶1∶2
②反应混合物中,SO2、O2 与SO3 的物质的量之比为2∶1∶2 ③反应混合物中,SO3的质量分数不再改变
③反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ |
C.只有③ | D.只有① |