某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:
]请回答下列问题:
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率______________________。(填“减慢”或“加快”)
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是_____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
(14分)某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是。
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为。
(4)操作b为调节溶液的pH,你认为pH的调控范围是。
(5)产品晶体中有时会混有少量绿矾(FeS04·7H20),其原因可能是。(写出一点即可)。
(6)NiSO4·7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为。
(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
(1)F装置的烧杯中发生反应的离子方程式是;B装置中的现象是。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+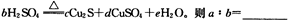
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol· 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为。(已知
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为。(已知 )
)
(15分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。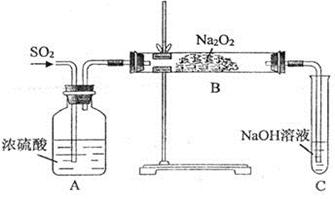
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据Na2O2和CO2的反应,用类比的方法推理Na2O2与SO2反应的固体产物为__________。另一部分同学依据SO2的强还原性和Na2O2的强氧化性,猜想产物中含有Na2SO4。为检验生成物中是否存在Na2SO4,他们设计了如下实验方案:
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,请分析通入SO2物质的量与溶液中溶质组成的关系,填写下表空格。
| n(SO2)的范围/mol |
溶液中溶质的化学式 |
| (0,0.5) |
__________ |
| __________ |
Na2SO3、NaHSO3 |
请在下图中画出溶液中溶质的总质量随缓慢通入SO2物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是。
(2)将SO2气体分别通入下列溶液中:
① 品红溶液,现象是;
② 溴水溶液,现象是;
③ 硫化钠溶液,现象是。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因,验证方法。
② 原因,验证方法。
③ 原因,验证方法。
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
 |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
 |
Fe3+具有氧化性 |
实验结论:。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:。(填序号)
A、Cl2
B、Na
C、Na+
D、Cl-
E、SO2
F、盐酸
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。