(15分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。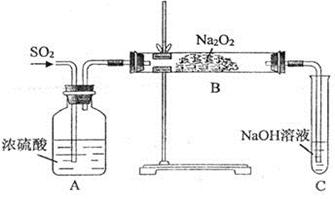
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据Na2O2和CO2的反应,用类比的方法推理Na2O2与SO2反应的固体产物为__________。另一部分同学依据SO2的强还原性和Na2O2的强氧化性,猜想产物中含有Na2SO4。为检验生成物中是否存在Na2SO4,他们设计了如下实验方案:
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,请分析通入SO2物质的量与溶液中溶 质组成的关系,填写下表空格。
| n(SO2)的范围/mol |
溶液中溶质的化学式 |
| (0,0.5) |
__________ |
| __________ |
Na2SO3、NaHSO3 |
请在下图中画出溶液中溶质的总质量随缓慢通入SO2物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用__ __(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②____________________。
(4)FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
| A.KMnO4溶于水不放热,可以直接在容量瓶中溶解 |
| B.容量瓶洗涤后不需干燥即可直接用于实验 |
| C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平 |
| D.如果定容时加水超过刻度线必须毓配制 |
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下:
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大”、“偏小”或“不变”)。
氯化钠是氯碱工业的主要原料,其晶体不带有结晶水,饱和食盐水也是实验室常用试剂。完成下列填空:
(1)粗盐中含有Ca2+、Mg2+、SO42―等离子和少量泥沙,某同学设计的提纯步骤依次为:溶解、过滤、加入沉淀剂、调pH、蒸发结晶。其中还缺少的步骤是_________。
(2)电解饱和食盐水实验中,检验阳极产物的试剂是________________;若用粗盐配制饱和食盐水进行电解,则阴极区可能出现的异常现象是_________________。
(3)氯碱厂称固体烧碱为“片碱”。用滴定法测定片碱中杂质Na2CO3含量的过程如下:
称取样品,加水溶解;加入酚酞试液,用标准盐酸滴定至溶液由红色刚好变为无色;再加甲基橙,继续用标准盐酸滴定至终点。数据处理。实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是_______;用甲基橙作指示剂时,判断滴定达到终点的现象是________________;用酚酞作指示剂时,发生反应的离子方程式为_________________。
(4)下列关于饱和食盐水的用途及装置设计正确的是_________(填写编号)。
a.模拟工业制纯碱 b.制乙酸乙酯实验中接受产物
c.除去氯气中的氯化氢 d.实验室制乙炔
(5)在饱和食盐水中加入浓硫酸,会有大量固体析出。过滤、洗涤、得干燥固体。为确定该固体的成份,进行以下实验:①取少量固体溶于水,测得溶液显中性;
②称取1.961 g固体于坩埚中加热,发现有水生成,继续加热至固体恒重,称量质量为1.331 g。判断固体已恒重的操作是____________________;
③将1.331 g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀1.165 g。则原固体的成份是______________(写化学式)。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)第①步反应的化学方程式为 。第②步反应的化学方程式为 。
(2)可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
(3)检验CaO2·8H2O是否洗净的方法是 。
(4)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
(5)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出(选填“a”、“b”、“c”或“d”)。
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)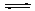 N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .
N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .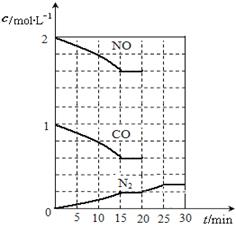
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).
20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂②降低温度
③缩小容器体积④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式 .
(4)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为 .