下列反应的离子方程式正确的是( )
| A.钠与水反应: 2Na+2H2O  2Na++2OH-+H2↑ 2Na++2OH-+H2↑ |
| B.钠与CuSO4溶液反应: 2Na+Cu2+  Cu↓+2Na+ Cu↓+2Na+ |
| C.NaHCO3溶液与稀H2SO4反应: CO 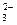 +2H+ +2H+ H2O+CO2↑ H2O+CO2↑ |
| D.NaOH溶液与小苏打溶液反应: |
HCO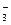 +OH-
+OH- CO
CO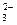 +H2O
+H2O
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是:()
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
镁粉与一定量某浓度的盐酸反应,但反应速度太快,为减慢反应速度,且不影响产生H2的总量,可向盐酸中加入的物质是()
| A.Na2CO3 | B.CH3COONa | C.NaOH | D.NaHCO3 |
一定温度下,某密闭容器中存在可逆反应:X Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )
Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )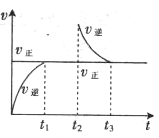
| A.X在该条件下一定不为气体 |
| B.Y和Z在该条件下至少有一种为气体 |
| C.t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同 |
| D.由t1~t3,平衡并未发生移动。 |
将PH为8的NaOH溶液与PH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
| A.2×10-10mol/L | B.1/2(10-8+10-10)mol/L | C.(10-8+10-10)mol/L | D.1/2(10-6+10-4) |
HClO是比H2CO3还弱的酸,当反应Cl2+H2O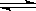 HCl+HClO达到平衡后,要使HClO的浓度增加,可加入()
HCl+HClO达到平衡后,要使HClO的浓度增加,可加入()
| A.NaOH固体; | B.NaCl固体; | C.H2O | D.CaCO3固体 |