有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
下图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是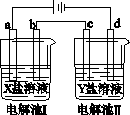
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
| A.正极反应为AgCl+e-===Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
工业上常用Fe作电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2 2 2 |
D.甲中阳极附近溶液中的离子反应方程式是: +6Fe2++14H+ +6Fe2++14H+ 2Cr3++6Fe3++7H2O 2Cr3++6Fe3++7H2O |
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则
A.电流方向:电极Ⅳ→  → 电极Ⅰ → 电极Ⅰ |
| B.电极Ⅰ发生还原反应 |
| C.电极Ⅱ逐渐溶解 |
| D.电极Ⅲ的电极反应:Cu2++2e-===Cu |
用惰性电极电解饱和食盐水,当电源提供给0.2 mol电子时停止通电。若此溶液体积为2L,则所得电解液的pH是
| A.1 | B.8 | C.13 | D.14 |