用惰性电极电解饱和食盐水,当电源提供给0.2 mol电子时停止通电。若此溶液体积为2L,则所得电解液的pH是
| A.1 | B.8 | C.13 | D.14 |
下列各组中的性质比较,正确的是
| A.酸性HClO4>HBrO4>HIO4 | B.碱性NaOH>Mg(OH)2>Ca(OH)2 |
| C.稳定性:HI>H2S> HCl | D.氧化性:Na+>Mg2+>Al3+ |
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.X2Y可能是离子化合物,也可能是共价化合物 |
| D.两元素形成的化合物中,原子个数比不可能为1︰1 |
下列说法正确的是
| A.14CO2的摩尔质量为46g |
| B.2.0g D2O中含有6.02×1023个中子 |
| C.标准状况下,2.24L CCl4所含的原子数为0.5NA |
| D.50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol |
下列化学用语正确的是
A.HCl的电子式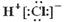 |
B.Cl-的结构示意图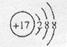 |
C.CO2的电子式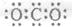 |
D.质量数为37的氯原子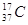 |
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
| A.若质量相等,则质子数相等 | B.若原子数相等,则中子数相等 |
| C.若分子数相等,则体积相等 | D.若体积相等,则密度相等 |