关于Na+的描述正确的是( )
| A.是银白色金属 | B.极易被氧化 |
| C.可存在于晶体或溶液中 | D.水溶液呈碱性 |
将 lmolSO2和 l mol O2通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是()
| A.0.3mol | B.0.15mol |
| C.小于 0.15mol | D.大于0.15mol而小于 0.3mol |
在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响,如CaAl2Si2O8 + Mg2SiO4 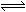 CaMg2Al2Si3O12
CaMg2Al2Si3O12
(钙长石)(镁橄榄石) (钙镁)石榴子石
密度: 2.70 3.22 3.50g·cm-3
则在地壳区域高压条件下,有利于
| A.钙长石生成 | B.镁橄榄石生成 |
| C.钙长石和镁橄榄石共存 | D.(钙镁)石榴子石生成 |
反应3Fe(s)+4H2O(g) 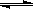 Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.将过量的Fe 块换成少量的Fe粉 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入 Ne使体系压强增大 |
| D.压强不变,充入Ne使容器的体积增大 |
某温度下,在一容积可变的容器中,反应2A(g)+B(g)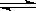 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
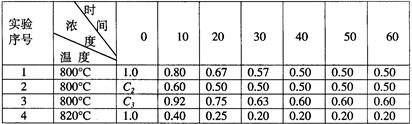
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c(2)= mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<=, 且c3=____________mol·L-1。
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
。