已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
(1)写出下列物质的化学式:A___________,B__________,C__________,D________,E____________________。
(2)写出A受热分解的化学方程式:_______________________________。
某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。试求:
①该有机物的最简式________。
②若符合该最简式的A物质可能不止一种,则它们之间的关系________(填序号)
A.一定互为同系物B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发生酯化反应,且所有碳原子在同一链上,则A的结构简式为________。
巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
(1)化合物F的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)在上述转化过程中,反应②的目的是________,写出反应②的化学方程式为________。(3)下列说法正确的是________(双选,填字母)。
A.化合物A ~ F均属于芳香烃衍生物
B.反应①属于还原反应
C.1 mol 化合物D可以跟4 mol H2发生反应
D.化合物F含有的官能团名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式为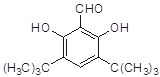 ,请写出另外一种同分异构体的结构简式________。
,请写出另外一种同分异构体的结构简式________。
A.属于芳香族化合物;
B.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
C.1mol该物质最多可消耗2molNaOH
D.能发生银镜反应。
化学式为C5H12O的有机物,可与金属钠反应产生氢气,试根据下列性质按要求填空。
(1)若该有机物可去氢被氧化成羰基化合物,而不能发生脱水消去反应,则该有机物可能氧化生成的羰基化合物的结构简式为。名称
(2)若该有机物不能去氢被氧化成羰基化合物,而能发生脱水消去反应,则该有机物的结构简式可能为。名称
完成下列化学方程式(8分)
(1) 与足量金属钠发生反应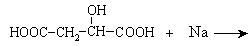
(2) 与NaOH的醇溶液共热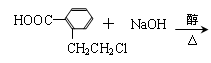
(3) 葡萄糖和新制Cu(OH)2及NaOH共热
(4)与足量H2反应
OHC-CH=CH-COOH+H2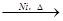
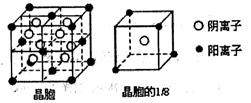
(12分):【化学——物质结构与性质】
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是,电负性最大的是,原子半径由小到大的顺序为。 (填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是(填相关物质的分子式);其原因是。
(3)A和E可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为,含阴离子的数目为,该离子化合物的化学式为。