下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。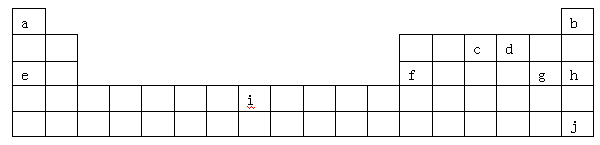
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图__________。
(2)由以上元素形成的金属单质中,熔点最低的是__ __。(填元素符号)
(3)NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
(4)a位于第ⅠA族,有人认为a也可以放在ⅦA族,下列物质能支持这种观点的是 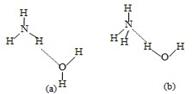
| A.HF | B.H3O+ | C.NaH | D.H2O2 |
(5)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写字母)。
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出该反应的方程式:
(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示: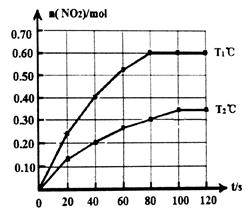
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使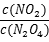 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度b.升高温度
c.向混合气体中通入NO2d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。
(18分)(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知: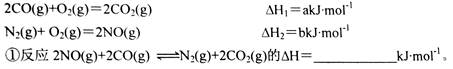
②可以利用反应: (n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3b.CO2c.SO2d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2____________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式________________________________________
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于_______法。
(16分)天然气在生产、生活中具有广泛的应用。
(1)CO2(g)+4H2(g) CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
(2)另一合成CH4的原理:CO(g)+3H2(g) CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
(3)某实验小组依据甲烷燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,乙池中盛有1L lmo1·L-1CuSO4溶液。a电极通入的气体为CH4,其电极反应式是______,b电极的现象为______。一段时间内乙池中溶液的pH由2变为1,则在这段时间内转移电子的物质的量为________mol。
某汽车安全气囊的产气药剂主要含有
、
、
、
等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)
是气体发生剂,受热分解产生
和
,
的电子式为。
(2)
是主氧化剂,与
反应生成的还原产物为(已知该反应为置换反应).
(3)
是助氧化剂,反应过程中与
作用生成
和
。
含有化学键的类型为,
的原子结构示意图为。
(4)
是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为。
(5)100
上述产气药剂产生的气体通过碱石灰后得到
33.6
(标准状况)。
①用碱石灰除去的物质为;
②该产气药剂中
的质量分数为。
物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态原子中,核外存在对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是。
(3)
分子中,共价键的类型有,
原子的杂化轨道类型是,写出两个与
具有相同空间构型和键合形式的分子或离子。
(4)
能与金属
形成
,该化合物的熔点为253
,沸点为376
,其固体属于晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个
原子连接个六元环,每个六元环占有个C原子。
②在金刚石晶体中,
原子所连接的最小环也为六元环,每个
原子连接个六元环,六元环中最多有个
原子在同一平面。