下列叙述正确的是
| A.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 |
| B.将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 |
| C.常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 |
| D.如果盐酸的物质的量浓度是醋酸的二倍,则盐酸的c(H+)也是醋酸的二倍 |
可逆反应 CO(g) + H2O(g)  CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为( )
CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为( )
| A.80% | B.75% | C.50% | D.25% |
在一个体积为2L的容器中,充入4mol CO和4mol H2O, 一段时间后反应CO(g) + H2O(g)  CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为( )
CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为( )
| A.27 | B.36 | C.54 | D.81 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是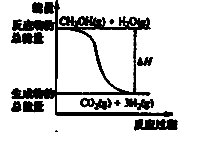
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是( )
| A.反应①中的能量变化如右图所示 |
| B.CH3OH转变成H2的过程一定要吸收能量 |
| C.根据①推知反应:CH3OH(l)+H2O(g)=CO2(g)+3H2(g)的 △H> + 49.0kJ·mol-1 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H<-192.9kJ·mol-1 |
在恒温条件下,一定体积的容器中放入3L气体R和2L气体Q,在一定条件下发生反应:4R(g)+3Q(g) 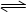 2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小15%,则反应中方程式的n值是()
2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小15%,则反应中方程式的n值是()
| A.4 | B.5 | C.6 | D.7 |
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH3=-Q2kJ·mol-1
取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为()
| A.0.4Q1+0.15Q2 | B.0.2Q1+0.05Q2 |
| C.0.2Q1+0.15Q2 | D.0.2Q1+0.3Q2 |