下列离子方程式正确的是
A.用惰性电极电解饱和食盐水:Cl-+ H2O 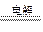 H2↑+ Cl2↑+ OH- H2↑+ Cl2↑+ OH- |
|
B.向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2 + 2Fe3+ ="=" 2Fe(OH)3↓+ 3Mg2+  |
C.向溶液中加入盐酸: |
| D.向Na2SiO3溶液中加入盐酸:Na2SiO3+ 2H+ ="=" H2SiO3↓+2Na+ |
下列叙述正确的是
| A.SiO2和CO2中,Si和O、C和O 之间都是共价键 |
| B.离子化合物中一定有金属元素 |
| C.蛋白质溶液、淀粉溶液和蔗糖溶液都是胶体 |
| D.共价化合物中各原子都满足8电子稳定结构 |
只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是
| A.氢氧化钠溶液 | B.氢氧化铜悬浊液 |
| C.石蕊试液 | D.碳酸钠溶液 |
下列反应不能引入羟基的是
| A.还原 | B.酯化 | C.加成 | D.水解 |
为防止有机物挥发,可加一层水保存,即水封。下列有机物中,既能用水封法保存,又能发生水解和消去反应的是
| A.乙醇 | B.溴乙烷 | C.乙酸乙酯 | D.四氯化碳 |
如图是常见四种有机物的比例模型示意图。下列说法正确的是
| A.甲的二氯代物只有一种 |
| B.乙不能与溴水发生反应而使溴水褪色 |
| C.1mol丙中含有碳碳双键的数目是3NA |
| D.丁在稀硫酸作用下可与甲酸发生取代反应 |