下列反应的离子方程式正确的是
| A.CO2通入CaCl2溶液中:Ca2++CO2+H2O===CaCO3↓+2H+ |
| B.FeSO4溶液中加入H2O2溶液:2Fe2++H2O2+2H+===2Fe3++2H2O |
| C.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO+OH-===CaCO3↓+H2O |
| D.石灰石溶于醋酸:CaCO3+2H+===Ca2++CO2↑+H2O |
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(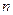 )如下表所示。下列说法正确的是
)如下表所示。下列说法正确的是
| X |
Y |
W |
|
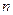 (起始状态)/mol (起始状态)/mol |
2 |
1 |
0 |
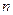 (平衡状态)/mol (平衡状态)/mol |
1 |
0.5 |
1.5 |
A.该温度下,此反应的平衡常数表达式是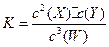 |
| B.升高温度,若W的体积分数减小,则此反应△H>0 |
| C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
D.该温度下,再向容器中通入3 mol W,达到平衡时, |
下列说法正确的是
A.pH=5的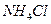 溶液或醋酸中,由水电离出的 溶液或醋酸中,由水电离出的 均为10 均为10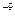 mol/L mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
C.在c(H ):c(OH ):c(OH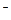 )=1:10 )=1:10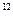 的溶液中,Na 的溶液中,Na 、I 、I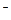 、 、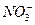 、 、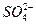 能大量共存 能大量共存 |
D.0.1 mol/L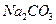 溶液和0. 1 mol/L 溶液和0. 1 mol/L 溶液等体积混合,溶液中 溶液等体积混合,溶液中 |

下列说法正确的是
A.将铁粉加入 、 、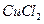 混合溶液中,充分反应后剩余的固体中必有铁 混合溶液中,充分反应后剩余的固体中必有铁 |
B.将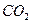 和 和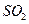 混合气体分别通入 混合气体分别通入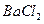 溶液、 溶液、 溶液中,最终都有沉淀生成 溶液中,最终都有沉淀生成 |
C.检验某酸性溶液中 和 和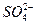 ,选用试剂及顺序是过量 ,选用试剂及顺序是过量 溶液、 溶液、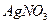 溶液 溶液 |
D.用加热分解的方法可将 固体和Ca(OH)2固体的混合物分离 固体和Ca(OH)2固体的混合物分离 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,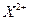 和
和 离子的电子数之差为8。下列说法不正确的是
离子的电子数之差为8。下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是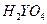 |
下列实验操作不能达到其对应目的的是
| 编号 |
实验操作 |
目的 |
| A |
取 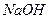 加入96mL水中 加入96mL水中(水的密度近似看作1g/ 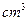 ) ) |
配置4%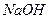 溶液 溶液 |
| B |
滴定实验中,用待测液润洗锥形瓶 |
避免造成误差使滴定结果偏低 |
| C |
向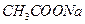 溶液中滴入酚酞溶液,加热 溶液中滴入酚酞溶液,加热 |
证明升高温度能促进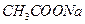 水解 水解 |
| D |
向盛有铜片的试管中加入浓硫酸,加热 |
证明浓硫酸具有强氧化性 |