工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4Fe2O3+SO2↑+SO3↑
某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)x溶液、(Ⅲ)NaOH溶液的三个装置。则下列对该方案的评价中正确的是
| A.(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(Ⅱ)所盛x应为品红溶液 |
| D.(Ⅲ)的作用是检验生成的SO2气体 |
120℃时,1V某烃和4VO2混合,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子中所含的碳原子数不可能是
| A.1 |
| B.2 |
| C.3 |
| D.4 |
关于金属腐蚀的如下各叙述中,正确的是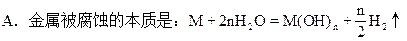
B.马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为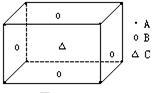
A.1∶3∶1
B.2∶3∶1
C.2∶2∶1
D.1∶3∶3
R为某短周期中的元素,其原子所具有的电子层数为最外层电子数的1/2,它可形成的酸根离子有:①R2O42-;②RO42-;③R2O32-;④RO32-。下列判断错误的是
| A.当它形成①时,不可能形成②③ |
| B.当它形成②时,可以形成③④ |
| C.当它形成①时,也能形成④ |
| D.当它形成②时,可以形成① |
可以肯定溶液中大量存在CO32-的理由是
| A.加入AgNO3溶液有白色沉淀产生 |
| B.加入稀盐酸有无色无味气体产生 |
| C.加入MgCl2溶液时有白色沉淀产生,再加入稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体 |
| D.加入Ba(OH)2溶液有白色沉淀产生,再加入稀盐酸,反应现象如C所述 |