对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时4v正(O2)=5v逆(CO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况屯的密度为0.76g·L—1;W的质子数是X、Y、Z、M四种元素质子数之和的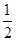 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.在上述五种元素形成的单质中,X元素可形成几种同素异形体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
下表中'对陈述I、Ⅱ的正确性及两者间因果关系的判断,完全正确的是
下列化学用语书写正确的是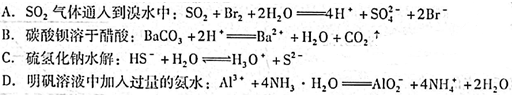
示意图或图示能够直观形象地呈现化学知识。下列示意图或图示正确的是

A. B. 

C.D.
化学与科学、技术、社会、环境密切相关。下列有关说法不正确的是
| A.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| B.高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” |
| C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |