下列溶液中微粒的物质的量浓度关系不正确的是
| A.若将适量CO2通入0.1 mol·L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+ c(HCO3ˉ)=" 0.1" mol·L-1 |
| B.在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
| D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
一定条件下,使X(g)与Y(g)在2L密闭容器中发生反应生成z(g)。温度为TK时,反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T, K和T2 K时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率V(X)=0.1 mol/(L·min) |
B.平衡时容器内的压强为反应前的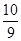 倍 倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
反应A(g)+B(g)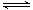 C(g)+D(g)过程中的能量变化如图所示,由此可判断
C(g)+D(g)过程中的能量变化如图所示,由此可判断
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是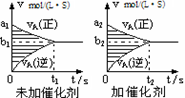
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
一定温度下,反应 N2(g) + O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图的所示.下列描述正确的是
| A.从反应开始到10 s末,用Z表示的反应速率为0.158 mol/(L·s) |
| B.从反应开始到10 s末,用X表示的反应速率为0.79 mol/(L·s) |
| C.从反应开始到10 s末,Y的转化率为79.0% |
| D.该反应的化学方程式为X(g)+Y(g)=Z(g) |