已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气。下列叙述正确的是( )
| A.LiH的水溶液显中性 |
| B.LiH中的氢离子可以被还原成氢气 |
| C.LiH是一种强氧化剂 |
| D.LiH中氢离子比锂离子的离子半径大 |
我们已复习过硫酸亚铁溶液中加入过氧化钠时可发生氧化还原反应,则下列说法正确的是
| A.该反应中Fe2+是还原剂,O2是还原产物 |
| B.4 mol Na2O2在反应中共得到8NA个电子 |
| C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子 |
| D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
下列各项表述与示意图形不一致的是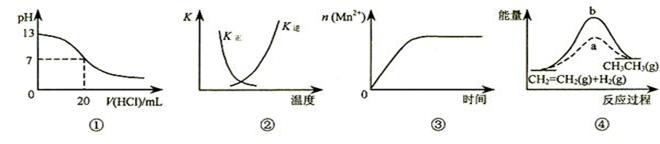
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g) 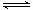 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量0.1 mol·L-1草酸溶液混合,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g) →CH3CH3(g);ΔH>0使用和未使用催化剂时,反应过程中的能量变化 |
下列离子或分子组能大量共存,且满足相应要求的是
| 选项 |
离子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO3-、SO32-、Cl- |
逐滴滴加盐酸立即有气体产生 |
| C |
Na+、HCO3-、Mg2+、SO42- |
逐滴滴加氨水立即有沉淀产生 |
| D |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH浓溶液立即有气体产生 |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列有关说法中不正确的是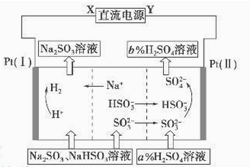
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.图1定量测定H2O2的分解速率 |
| B.图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D.图4证明CH3CH2OH发生消去反应生成了乙烯 |