某元素M所形成的气态单质分子M2有三种,其相对分子质量分别为70、72、74,三种分子的物质的量之比为9∶6∶1,下列说法正确的是( )
| A.M有三种同位素 |
| B.M2的平均相对分子质量为72 |
| C.质量数为35的同位素占原子总数的75% |
| D.M的一种同位素的质量数为37 |
下列溶液一定呈中性的是()
| A.pH=7的溶液 | B.c(H+)=c(OH-)=10-6mol/L溶液 |
| C.使石蕊试液呈紫色的溶液 | D.酸与碱恰好完全反应生成正盐的溶液 |
已知2H2(g)+ O2(g)=2H2O(g) △H= ─484KJ/moL,则反应H2O(g)= H2(g)+  O2(g) 的△H为
O2(g) 的△H为
| A.─484kJ/mol | B.+484kJ/mol | C.─242kJ/mol | D.+242kJ/mol |
下列物质属于同系物的是
| A.CH3CH2CH2OH与CH3OH | B.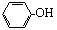 与 与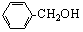 |
| C.乙酸与HCOOCH3 | D.CH3CH2Cl与CH3CH2CH2Br |
下列各组物质中,第一种是含氧酸,第二种是强电解质,第三种是混合物的是()。
| A.水、纯碱、空气 | B.HNO3、盐酸、碱石灰 |
| C.H2SO4、NaCl、烟 | D.Fe2O3、BaSO4、饱和食盐水 |
禁止使用兴奋剂是奥运会保证运动员比赛公平的重要举措之一。以下两种兴奋剂结构分别为: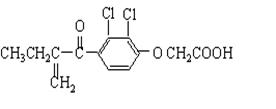

①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是( )
| A.利尿酸分子中有三种官能团 | B.两种分子中的所有碳原子均不可能共平面 |
| C.两种兴奋剂均属于芳香烃 | D.两种分子均可发生加成反应 |