RO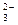 +2R
+2R +6H
+6H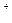
 3R+3H
3R+3H O是某同学作业中的一个离子方程式,其中R
O是某同学作业中的一个离子方程式,其中R 所带电荷模糊不清,若R所带电荷用x表示,则x应是( )
所带电荷模糊不清,若R所带电荷用x表示,则x应是( )
| A.“+” | B.“2-” |
| C.“3+” | D.“4-” |
已知:SO2(g)+1/2O2(g) 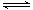 SO3, ΔH = -98kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2mol SO2和0.1mol O2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是()
SO3, ΔH = -98kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2mol SO2和0.1mol O2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是()
| A.5min内用O2表示的反应速率为0.12mol/(L·min) |
| B.该反应的平衡常数数值为7.5 |
| C.SO2的平衡转化率为60% |
| D.加入催化剂,可使ΔH变小 |
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是()
| A.丙与戊的原子序数相差28 |
| B.气态氢化物的稳定性:庚<己<戊 |
| C.常温下,甲和乙的单质均能与水剧烈反应 |
| D.丁的最高价氧化物不与任何酸反应 |
25℃、101kPa下,碳、氢气和甲烷的燃烧热依次是393.5 kJ·mol—1、285.8 kJ·mol—1
和890.3kJ·mol—1,下列选项中正确的是()
| A.2H2(g)+O2(g)=2H2O(l)△H=—285.8kJ·mol—1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ·mol—1 |
| C.H2(g)+1/2O2(g)=H2O(g)△H<—285.8kJ·mol—1 |
| D.C(s)+2H2(g)=CH4(g)△H=—74.8 kJ·mol—1 |
化学与生产、生活息息相关,下列叙述错误的是()
| A.碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 |
| B.汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 |
| C.1kg人体脂肪可存储约32200kJ能量,一般人每行走1km大约要消耗170kJ能量,如果每天步行5km,一年(按365天计)中消耗的脂肪大约是9.6kg |
| D.炒菜用铁锅未及时洗净(残余中含NaCl),可能发生电化学腐蚀生成红褪色锈斑 |
某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl-、SO42-、NO3-、AlO2- 中的若干种离子,离子浓度均为0.1 mol·L-1,某同学进行了如下实验: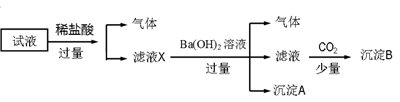
下列说法正确的是()
| A.无法确定原试液中是否含有Fe3+、K+ |
| B.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ |
| C.无法确定沉淀B的成分 |
| D.原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |