(8分)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol,试完成下列问题:
(1)烃A的分子式是_________。
(2)若取一定量的烃A充分燃烧后,生成B、C各3 mol,则有_________g的A参加了反应,燃烧时消耗标准状况下的氧气_________ L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式是___________。
(4)若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成2,2-二甲基丁烷,则烃A的名称是_________,结构简式是_________。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_________种。
氮化铝(AlN)是一种新型无机非金属材料。某AlN 样品仅含有Al2O3 杂质,为测
定AlN 的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN 的纯度(夹持装置已略去)。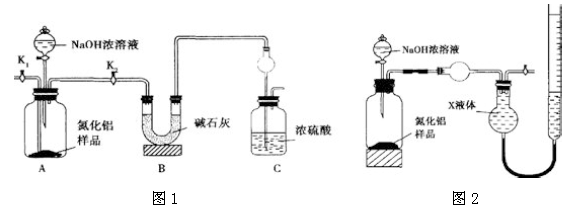
(1)图1 中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH 浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C 装置反应前后的质量变化。通入氮气的目的是 。
(3)假设其他操作均正确,按照图1 装置将导致测定结果 (填“偏高”、“偏低”或“无影响”)。
【方案2】用图2 装置测定mg 样品中AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X 液体最好选择 。
a.CCl4b.H2O c.饱和NH4Cl 溶液 d.浓硫酸
(5)若m g 样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是 (需化简)。
【方案3】按下列路径测定样品中AlN 的纯度: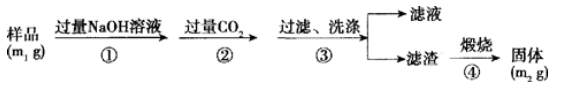
(6)写出步骤反应的离子方程式 。
(7)该方案能否测出AlN 的纯度?(若能请用m1,m2 列出计算纯度的表达式) 。
实验室要用Na2CO3·10H2O晶体配制500 mL 0.1 mol·L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3·10H2O____________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是____________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠______________________________________;
B.定容时加水超过刻度线________________________________________;
C.最终定容时俯视观察液面 。
下述实验操作与预期实验目的或所得实验结论不一致的是
| 编号 |
实 验 操 作 |
实验目的或结论 |
| A |
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 |
证明SO2有漂白性 |
| B |
向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 |
探究增大反应物浓度时平衡移动的方向 |
| C |
将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 |
探究温度对化学平衡的影响 |
| D |
将CO2通入Na2SiO3水溶液观察是否有沉淀产生 |
探究碳和硅两元素非金属性强弱 |
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)第④步中,相关的离子方程式是: 。
(3)步聚2中,判断沉淀已完全的方法是: 。
(4)除杂试剂Na2CO3、NaOH、BaCl2加入的顺序还可以是
(5)为检验精盐纯度,需配制100 mL 1 mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是
(6)配制100 mL 1 mol/L NaCl溶液过程中,下列操作情况会使结果偏低的是
| A.称量时,托盘天平左盘加砝码,右盘加氯化钠 |
| B.移液前,容量瓶中有少量蒸馏水未倒出 |
| C.定容时,仰视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线。 |
利用下图装置测定中和热的实验步骤如下: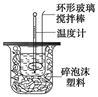
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_________ __________________。
(2)倒入NaOH溶液的正确操作是:____________。 (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1) /℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH =__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中