某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + ____ H+ =" ____" Mn2+ + ____ CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):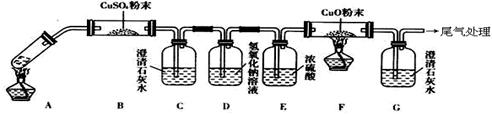
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色。据此回答:
上述装置中,D的作用是__________________.
乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化)。则下列关系合理的是
A.c(Na+)+c(H+)=c(HC2O4—)+c(OH—)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)="0.2" mol·L-1
C. c(HC2O4-)>c(C2O42—)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—)
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目
。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有_______(填名称),发生反应的离子方程式为。
(5)实验结束时,应先熄灭__________处酒精灯。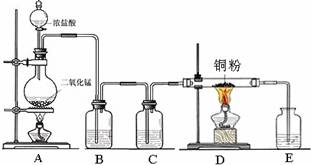
现有铝片、铝粉、镁条、氧化铝、氧化铁、氯化亚铁、盐酸、氯酸钾及其它必用实验用品和仪器,根据现有药品,请你设计2种简单的实验方案证明铝、铁金属单质的还原性强弱(用化学方程式表示)。
方案一:;
方案二:。
中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。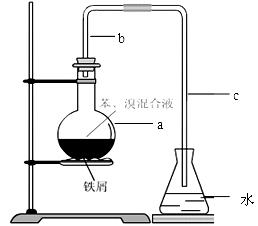
⑴导管b的作用有两个:一是导气,二是兼起的作用;
⑵a中反应的化学方程式为;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗。
正确的操作顺序为()
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入;但该实验不够严密,为此必须在导管a、b之间加上一盛有的洗气瓶,目的是。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下: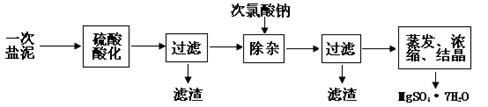
(1)用硫酸调整溶液pH到1~2,硫酸的作用是。 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO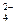 )=。
)=。
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,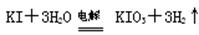
方法3: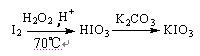
⑴与方法3相比方法1的不足是,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b.。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
| 滴定次数 |
盛标准Na2S2O3溶液的读数 |
|
| 滴定前刻度(/mL) |
滴定后刻度(/mL) |
|
| 1 |
1.02 |
11.03 |
| 2 |
2.00 |
11.99 |
| 3 |
0.20 |
10.20 |