中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。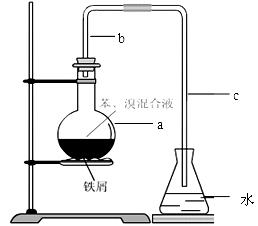
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入 ;但该实验不够严密,为此必须在导管a、b之间加上一盛有 的洗气瓶,目的是 。
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:。
(3)本实验的关键在于关闭气体流量计的时机,请问应当在什么时候关闭活塞A:。
乙方案:实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式 。
。
(5)如何判断步骤②中沉淀是否完全的方法。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)
为(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制备氯气 |
HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能 实现的是(填气体
实现的是(填气体
的化学式,下同);从反应原理看,明显不同于其他两种气体的是。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上
表中的空格中。
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: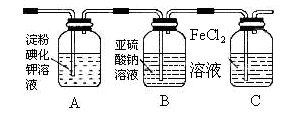
①通入氯气后,A中的现象是,整套实验装置存
在的明显缺陷是。
②C装置中发生反应的离子方程 式为:
式为:
 。
。
③请你帮该小组同 学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
(4)若用排空气法收集Cl2,在右边方框内画出气体收集装置图。
有一包白色固体粉末,可能由硫酸钠、硝酸钾、硝酸铵、碳酸钙、氯化钡、硫酸铜中的一种或几种组成,做实验得以下结果:
⑴将此固体粉末加到水中,得到白色沉淀和上层无色清液;
⑵过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清石灰水变浑浊;
⑶在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝。
由此实验推断:该粉末中一定含有_________________________________________;
一定不含有_______________________;可能含有____________________。(填化学式)
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。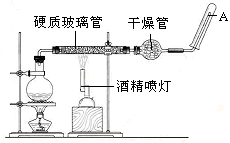
请回答该实验中的问题。
(1)写出该反应的反应方程式:;
(2)实验前必须进行的操作是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)酒精灯和酒精喷灯点燃的顺序是
(5)干燥管中盛装是的物质是,作用是。
(6)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题。
(1)写出该反应的反应方程式:;
(2)实验前必须进行的操作是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)酒精灯和酒精喷灯点燃的顺序是,
(5)干燥管中盛装是的物质是,作用是。
(6)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。