某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL)。实验装置如下 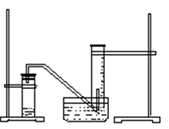
请回答:(1)进行此实验时,必须保证气密性良好,如何检验此装置的气密性?
____________________________________________________________________
(2)以下是测量收集到气体体积必须包含的几个步骤:
a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;
c.读取量筒内气体的体积。
这三个操作步骤的正确顺序是(填写代号) _____________________。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
_______________________________________________________
进行该操作的目的是___________________________________________
(4)如果实验中得到的氢气体积是VmL(已折算成标准状况),水蒸气的影响忽略不计
锌的摩尔质量的计算式为(含W、V,不必化简):M(Zn)= _______________________
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: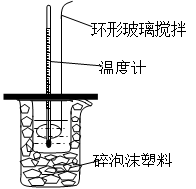
(1)烧杯中填满碎泡沫塑料的作用是 。
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 。
(3)实验中若改用60mL0.50mol/L的盐酸与50 mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),若实验操作均正确,则所求中和热 (填“相等”或“不相等”)。
(4)已知在稀溶液中,强酸与强碱发生中和反应生成1molH2O,放出57.3kJ的热量,则上述反应的热化学方程式为
(5)实验中若改用60mL0.50mol/L的醋酸与50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“偏低”或“偏高”);原因是 。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(1)步骤②加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(4)实验中用浓硫酸配制250mL1 mol/L的稀硫酸,配制时用到的玻璃仪器除了烧杯以外,还有 。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 |
温 度(℃) |
催化剂用量(g) |
酸性高锰酸钾溶液 |
实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 |
| 体积(mL) |
浓度(mol•L-1) |
|||
| 1 |
25 |
0.5 |
4 |
0.1000 |
| 2 |
50 |
0.5 |
4 |
0.1000 |
| 3 |
25 |
0.5 |
4 |
0.0100 |
| 4 |
25 |
0 |
4 |
0.1000 |
(4)写出表中a 对应的实验目的 ;
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间(min) |
||
| 第1次 |
第2 次 |
第3 次 |
|
| 1 |
14.0 |
13.0 |
11.0 |
| 3 |
6.5 |
6.7 |
6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示) 为 。
(19分)晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.
已知:在一定条件下可发生反应:Si(s)+3HCl(g)  SiHCl3(g)+H2(g) ΔH<0
SiHCl3(g)+H2(g) ΔH<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择_______(填序号字母),原因是_______________;
a .520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 |
SiCl4 |
SiHCl3 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
33.0 |
- |
315 |
| 升华温度/℃ |
- |
- |
180 |
300 |
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:
2NaCl(s) + H2SO4(浓)  2HCl↑ + Na2SO4
2HCl↑ + Na2SO4
A中是HCl的发生装置,你认为应选择下列哪套装置?____________(填装置的序号字母),装置D中碱石灰的作用为__________________、___________________;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为_____________(填操作名称),下列不是该操作所需的仪器是____________________(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f. 接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:
①按图示组装好仪器后,下列实验步骤的正确顺序为____________(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为____________(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是________________________。
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:容量瓶 (规格: )、托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响: ,原因是: 。
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。