(19分)晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)  SiHCl3(g)+H2(g) ΔH<0
SiHCl3(g)+H2(g) ΔH<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择_______(填序号字母),原因是_______________;
a .520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 |
SiCl4 |
SiHCl3 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
33.0 |
- |
315 |
| 升华温度/℃ |
- |
- |
180 |
300 |
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:
2NaCl(s) + H2SO4(浓)  2HCl↑ + Na2SO4
2HCl↑ + Na2SO4

A中是HCl的发生装置,你认为应选择下列哪套装置?____________(填装置的序号字母),装置D中碱石灰的作用为__________________、___________________;

(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为_____________(填操作名称),下列不是该操作所需的仪器是____________________(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f. 接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:

①按图示组装好仪器后,下列实验步骤的正确顺序为____________(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为____________(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是________________________。
I.现有下图所示装置,为实现下列实验目的,其中应以a端作为入口的是 。
A.瓶内盛碱石灰,用以干燥气体
B.瓶内盛饱和食盐水,用以除去Cl2中混有的少量HCl
C.瓶内盛水,用以测量某难溶于水的气体体积
D.瓶内贮存气体,加水时气体可被排出
E.收集密度比空气大的气体
F.收集密度比空气小的气体
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制浓度为1mol·L-1的稀硫酸480mL。
(1)从下列用品中 选出实验所需要的仪器
A.1000mL烧杯 B.100mL烧杯 C.10mL量筒 D.50mL量筒
E.500mL容量瓶 F.1000mL容量瓶 G.广口瓶H.托盘天平
(2)除选用上述仪器外,还缺少的必要仪器或用品是
(3)需取用浓硫酸的体积为mL (结果保留一位小数)
(4)下列情况中,会使所配溶液的浓度偏低的是
A.将量筒中的浓硫酸转入烧杯后,用水洗涤量筒,将洗液也转入在烧杯中
B.稀释浓硫酸后立即转入容量瓶
C.定容时加水不慎超过刻度线
D.定容时仰视刻度线
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。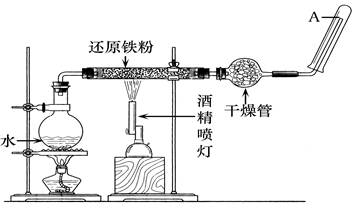
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是。
(4)干燥管中盛装的物质可以是,作用是。
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是 。
如下两个反应: A、NaOH+HCl=NaCl+H2O B、2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。其理由_________________________________________________________。
(2)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子的流动方向,写出电极反应式。

________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是。
(2)B中溶液发生反应的离子方程式是。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是
。
(4)过程Ⅲ实验的目的是。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐,得电子能力逐渐______。
考查知识点:卤素单质氧化性强弱的比较,对应实验原理、操作、现象的描述,从结构上理解氧化性递变的原因。
1,2,3,4—四氢化萘的结构简式如下图, 分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+ 4Br2→ C10H8Br4+ 4HBr生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④ 分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1) 如图所示的装置, 适合步骤①和②的操作的是。
(2) 步骤②中如何判断“反应完全”_________________________________________。
(3) 步骤③中补充少量四氢化萘的目的是。
(4) 步骤③中过滤后得到的固体物质是_____________________。
(5) 已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中水和四氢化萘的质量比约是1:____________(保留小数点后1位)。