某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
| 方案1 |
|
| 方案2 |
|
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。
(5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有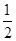 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
CO2和NaOH的反应是一个很基本的化学反应,有很多的实验方法可以通过观察到的明显现象说明CO2与NaOH溶液发生了反应.现提供如下实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品.现有五位同学设计了如图所示的A~E五个装置,试回答: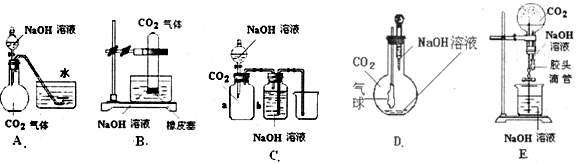
(1)对图A,当将分液漏斗中的NaOH溶液滴入烧瓶时,如果看到水槽中的水被吸入到烧瓶中,则证明CO2与NaOH溶液发生了反应.请写出此过程中NaOH溶液与CO2可能发生的反应离子方程式:__________________、____________________.
(2)对图B~E,请指出能达到实验目的的装置______________(用B、C、D、E填空).B中出现_______________________现象可证明CO2与NaOH发生了反应.
(3)将标准状况下一定体积的CO2气体缓慢通入V L NaOH溶液中,结果CO2和NaOH均无剩余.在反应后的溶液中加入足量的澄清石灰水得到W g沉淀.据以上数据能否确定CO2的体积?若能,请用上述数据求出CO2的体积.若不能,还需做什么实验?简要说明并运用实验测得的数据列式表示._________________________________________
为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。
(1)配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和。
(2)在丙组实验中滴定时是否需要选择指示剂?(填“需要”或“不需要”)。滴定终点的颜色变化是。
(3)用丙组的实验数据,计算Na2SO3的纯度。
(4)实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因。
为了证明有关物质的性质,某同学设计了如图所示的装置。当打开旋塞C,使A中液体与H中搁板上的固体B相遇时,即有气体产生,并发现D中的蜡烛慢慢熄灭;关闭C打开E时,则看到G中的蜡烛燃得更亮。请回答下列问题:
⑴请写出下列有关仪器的名称:AD
⑵请写出上图装置中有关仪器内盛放的物质的名称:A中,固体B,固体F
⑶用化学方程式表示F中发生的有关反应(用双线桥表示其中之一反应的电子转移方向和数目).
、
(4)、写出H中反应的离子方程式
为了测定某未知NaOH溶液的浓度,需要0.200mol·L-1的盐酸溶液500mL。某学生用实验室中常用的36.5%(密度为1.20g·cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用_____(从以下备选仪器中选取适当仪器,将其序号填入空格中)量取36.5%(密度为1.20g·cm-3)的浓盐酸________mL。a.50mL量筒; b.10mL量筒; c.托盘天平。
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入______________________(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2 ~3次一并转入其中。
~3次一并转入其中。
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是___________________________________。
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为____mol·L-1(精确到0.01)。
| 实验序号 |
滴定管液面起始读数 |
滴定管液面终点读数 |
| 1 |
1.32mL |
23.36mL |
| 2 |
2.26mL |
24.22mL |
⑶下列操作或叙述正确的是_____(填写序号)。
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是_____________________(填写序号)。
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
50 mL1.0 mol·L-1盐酸跟50mL1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应。通过测 定反应过程中所放出的热量可计算中和热。试回答下列问题。
定反应过程中所放出的热量可计算中和热。试回答下列问题。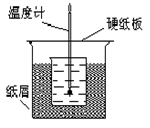
⑴大小烧杯间填满碎纸条的作用是什么?
⑵大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
⑶改用60 mL1.0mol·L-1盐酸跟50mL1.1mol·L-1氢氧化钠溶液进行反应,与上述实验相比,所测中和热的数值理论上是否相等(不考虑空气的影响)?简述理由。
⑷用相同浓度和体积的氨水代替NaOH溶液进行实验,为什么测得中和热的数值偏低?