(9分)1 mol某烷烃完全燃烧消耗8 mol O2,则其化学式为________________________。写出其可能的所有结构简式_____________________________________________。从理论上分析,碳原子数少于等于10的所有烷烃分子中,其一卤代烷不存在同分异构体的烷烃共有4种,请写出它们的结构简式:①______________________,②_________________________,③______________________________,④______________________________。
(共14分)对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式。
(2)PX可发生的反应有、(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。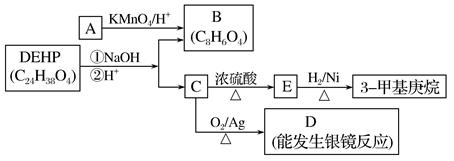
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是。
②D分子所含官能团是(填名称)。
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式。
糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:
(1)糖尿病是由于人体内胰岛素紊乱所导致的代谢紊乱综合症,以高血糖为主要标志。血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是______________。
A、葡萄糖属于碳水化合物,分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B、糖尿病人尿糖较高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C、葡萄糖可用于制镜工业
D、淀粉水解的过程中可以产生麦芽糖和蔗糖
(2)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含油脂和蛋白质。下列说法中错误的是_______________。
A、油脂和蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B、用灼烧闻气味的方法可以区别合成纤维和羊毛
C、人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D、紫外线、医用酒精能杀菌消毒,是因为可以使细菌的蛋白质变性
(3)某种蛋白质的结构片段如右图:
上述蛋白质结构片段完全水解所生成的氨基酸中属于芳香族化合物的是:__ ___。
(4)已知上述蛋白质结构片段的相对分子质量是307,则水解生成的各种氨基酸的相对分子质量之和为。
对比同体积、同浓度的盐酸和醋酸,c(H+)前者后者,与碱完全中和时,消耗NaOH的物质的量是前者后者,与足量的Zn反应产生H2的速率是前者后者,产生H2的量是前者后者。(填“>”、“<”或“=”)
(12分)恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
O2 (g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n(O2) = 4mol,n(SO3) = 4mol,计算a的值为。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)=。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 ;用O2表示从0~2 s内该反应的平均速率v= ;
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂