(10分)环己烯可以通过丁二烯与乙烯发生环化加成反应得到: (也可表示为:
(也可表示为: )
)
丁二烯 乙烯 环已烯
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷: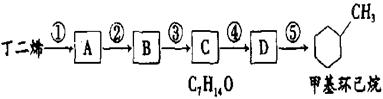
请按要求填空:
(1)A的结构简式是 ;B的结构简式是 。
(2)写出下列反应的化学方程式和反应类型:
反应④ ,反应类型 。
反应⑤ ,反应类型 。
I.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
| A.CH3CH3 | B.CH3CHCl2 |
| C.CH3CH2OH | D.CH3CH2Br |
(3)已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
II.在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇、乙酸分子中官能团的名称分别是_________、_________。
(2)试管a中发生反应的化学方程式为
_____________________________________________,
反应类型是______________。
(3)浓H2SO4的作用是:__________________________。
反应开始前,试管b中盛放的溶液是____________。
该溶液的作用是
___________________________________________________________________________________。
从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法主要有________(填一种)。
(2)从海水中提取镁的流程如下图所示: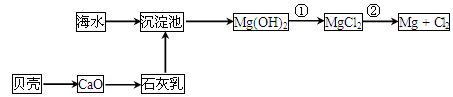
反应①的离子方程式为________________________________________________。
反应②的化学方程式为________________________________________________。
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为________________________________________________。
下表是元素周期表的一部分,回答下列问题: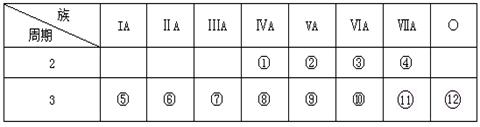
(1)写出①、③两种元素形成的化合物有两种化学式:____,____。
(2)写出①元素最高价氧化物的电子式和结构式____,____。
(3)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强。
I.丙烯酸的结构简式是:CH2 CHCOOH。试写出它与下列物质反应的化学方程式。
(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
II.4.6g某有机物完全燃烧,得到8.8g二氧化碳和5.4g水.此有机物的蒸气对氢气的相对密度为23(相同状况下).该有机物与金属钠反应放出氢气.其分子式为,结构简式为。
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。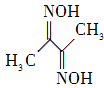
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。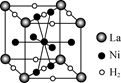
(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。