(本题共12分)二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式 ;
写出甲醇分子中官能团的电子式 。
29、碳与同主族的短周期元素相比,非金属性较强的是 (填元素符号)。写出一个能证明你的结论的化学方程式 。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是 (选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.40 |
0.16 |
0.16 |
| Ⅱ |
387 |
0.80 |
a |
|
| Ⅲ |
207 |
0.40 |
0.18 |
0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是 (选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为 (用含t的式子表示)。II号容器中a = mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向 (填“正”“逆”)反应方向进行。
将4 mol SO3气体和4 molNO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g)  2SO2+O2、2NO+O2
2SO2+O2、2NO+O2 2NO2
2NO2
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c(SO2)平= mol/L。
在容积为1L的密闭容器中,进行如下反应:
A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: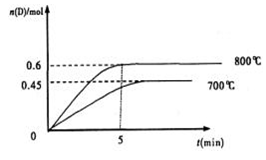
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
现有下列物质:
①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡
⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的电解质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(4)在水溶液中,不能完全电离的是 ;
(10分))对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增加或减少,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① |
HF |
Ka=6.8×10-4 mol•L-1 |
| ② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
| ③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
| ④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是、。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:_________________,
足量的CO2通入NaCN溶液中:______________。