选择以下物质填写下列空白:
| A.CO2 | B.NH4Cl | C.KOH | D.Na2O2 E.MgCl2 F.NH3 G.H2O2 |
⑴.含非极性共价键的离子化合物:___________________;
⑵.既有极性键也有非极性键的化合物:___________________;
⑶.晶体中存在氢键的是:___________________;
⑷.既含离子键也含极性键,同时还存在配位键的是:___________________;
⑸.晶体中,只含一种微粒间作用力的是:___________________。
(9分) 如图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)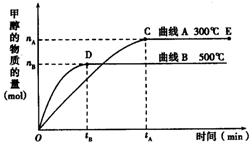
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
| A.H2的转化率一定增大 | B.v正一定增大,v逆一定减小 |
| C.CH3OH的质量分数一定增加 | D.v逆一定小于v正 |
(8分 ) CH3OH(g)+H2O(g)
) CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同 );在其它条件不变的情况下加压,则正反应速率
);在其它条件不变的情况下加压,则正反应速率 。
。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为。
(3)判断该可逆反应达到平衡状态的依据是(填序号)。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、H2O、CO2、H2的浓度都不再发生变化 |
已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l )完全燃烧的热化学方程式:。
)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L( 标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______ ________________。
________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。
如图是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,用排饱和食盐水的方法先后收集20 mL CH4和80 mL Cl2,进行实验。
(1)若研究甲烷与氯气的取代反应,还需要的条件是________________________________。
(2)若将如图所示装置放在光亮的地方,等待片刻,观察到的现象是__________________。
(3)若将如图所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(4)写出甲烷和氯气的第一步反应方程式。