下表是一些常用化学试剂的性质,根据表中所列信息选择的保存方法合适的是( )
| 浓硝酸 |
白磷 |
金属钠 |
液溴 |
金属锂 |
||||
| 易挥发;见光、受热易分解;易腐蚀橡胶 |
在空气中易被氧化,易自燃;难溶于水,易溶于二硫化碳;密度比水大 |
易与水、氧气等反应,与煤油、石蜡等不发生反应;密度小于水,大于煤油 |
极易挥发,不易溶于水,易腐蚀橡胶 |
易与水、氧气等反应,与煤油、石蜡等不发生反应;密度小于水和煤油
|
已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数()
| A.等于15% | B.大于15% | C.小于15% | D.无法估计 |
有关氨的说法不正确的是()
| A.NH3是4核10电子极性分子,三角锥形,具有还原性 |
| B.NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂 |
| C.氨气是非电解质,氨水是电解质 |
| D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟 |
我们平常所说的“五氧化二磷”,其分子组成实为“P4O10”,分子结构呈“笼”状,如图所示(图中●代表磷原子,○代表氧原子)。P4O10极易与水化合,它也可与乙醇、氨等某些具有强极性键的分子结合,反应过程与同水反应类似。每摩尔P4O10与足量的氨反应,最多可消耗氨的物质的量为()
| A.6 mol | B.8 mol | C.10 mol | D.12 mol |
由(NH4)2SO4和MgSO4组成的混合物共192 g,溶于水中配成10 L溶液。测得此溶液中c(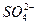 )为0.15 mol·L-1,则原混合物中
)为0.15 mol·L-1,则原混合物中 的物质的量是()
的物质的量是()
| A.0.1 mol | B.0.5 mol | C.1 mol | D.2 mol |
标准状况下,将盛满NO、NO2、O2混合气体的集气瓶倒置于水中,完全溶解,无气体剩余,假如其产物不扩散,则所得溶液的物质的量浓度c数值大小范围是()
A.0<c<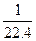 |
B. <c< <c<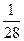 |
C.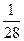 <c< <c<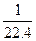 |
D. <c< <c<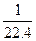 |