一定质量的钠、镁、铝分别与足量的硫酸反应。
(1)若放出氢气的体积比为1∶2∶3,则钠、镁、铝的物质的量之比为__________,质量比为__________。
(2)若放出氢气的体积相同,则钠、镁、铝的物质的量之比为__________,质量比为__________。
(10分,每空2分)A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________ (填序号)
(填序号)
a.C b.Al c.S d.Mg
(2)若X是日常生活中最常用的金 属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
反应②的离子方程式为:
C溶液中加入NaOH溶液后产生的现象是
(3)若A在常温下为气态化合物,C是红棕色的气体,C与水反应后所得的浓溶液D与铜反应又生成C气体。则:反应①的化学方程式:;
D的稀溶液与铜反应的离子方程式为:
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: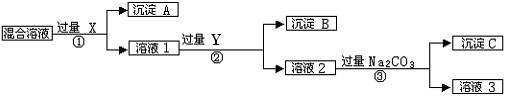
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X :,沉淀A:,试剂Y:,沉淀B:。
(2)上述实验流程中加入过量的Na2CO3的目的是。
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
(4)写出实验流程①②所涉及的离子方程式。
①;② 。
。
(5分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取铁酸钠的化学方程式是(未配平):
Fe(NO3)3 + NaOH + Cl2 → Na2FeO4 + NaNO3 + NaCl + H2O
(1)铁酸钠中,铁元素的化合价是;上述制取铁酸钠的反应中,铁元素被(填“还原”或“氧化”)。
(2)铁酸钠溶解于水,立即与水发生剧烈反应,放出氧气,正是这些在水中新产生出的氧原子发挥其极强的氧化能力给水杀菌消毒的。铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体,使水中悬浮物沉聚, Fe(OH)3胶体微粒直径的范围是__________nm,铁酸钠的电离方程式是 。
。
(1)向Ba(HCO3)2溶液中滴加少量的NaOH溶液,请写出发生反应的离子方程式:________________________________________;在以上溶液中继续滴加NaOH溶液至过量,请写出此步反应的离子方程式:。
(2)在氯化钾与氯化钙的混和物中,钾离子与钙离子的物质的量之比为1∶2,则该混合物 中KCl的质量分数为;含有1mol氯离子的该混合物的质量为_____________。
中KCl的质量分数为;含有1mol氯离子的该混合物的质量为_____________。
下列物质:①金属钠②Na2O固体③CO2气体④SO3气体⑤氨气⑥HCl气体⑦Ba(OH)2固体⑧熔融的NaCl ⑨蔗糖晶体 ⑩NaCl溶液。其
⑩NaCl溶液。其 中,
中, 属于电解质的是
属于电解质的是 ,属于非电解质的是,上述状态下能导电的是。
,属于非电解质的是,上述状态下能导电的是。