Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= .
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原白色粉末中肯定含有______________,可能含有____________。
(2)写出有关反应的离子方程式:______________________________________;
_______。
实验室配制250 mL 1.0 mol·L-1 H2SO4溶液,回答下列问题:
(1)需要18 mol·L-1 H2SO4溶液的体积是________mL。
(2)应选用下列______规格的量筒量取浓硫酸。
| A.10 mL | B.25 mL | C.50 mL | D.100 mL |
(3)某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把水倒出一些,重新加水至刻度线。这样做会使配制溶液的浓度________(填“偏高”、“偏低”或“无影响”)。
(4)某同学在向容量瓶中转移液体时,未用蒸馏水洗涤烧杯。这样做会使配制溶液的浓度________(填“偏高”、“偏低”或“无影响”)。
从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物。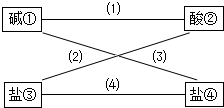
(1)写出下列各物质的化学式:
②③
(2)写出连线(2)的化学方程式:
写出物质④的电离方程式:
(3)写出连线(1)的离子方程式:。
(19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要(填“放出”或“吸收”)kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2=-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=" -92.2" kJ·mol-1
2NH3(g);ΔH=" -92.2" kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0.00 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为kJ。
②0~1小时内N2的平均反应速率mol·L-1·h-1
③此条件下该反应的化学平衡常数K=(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向方向移动(填“正反应”或“逆反应”或“不移动”)