中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。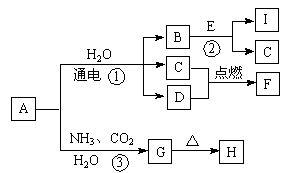
回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题: (1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_。
(1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_。
(2)在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为
0.9mol。则浓硫酸的实际体积____(填写“大于”、“等于”、或“小于”)100mL,你认为其主要原因是。
若 使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(
使剩余的铜片继续溶解,可在其中加入硝酸盐溶液( 如KNO3溶液),则该反应的离子方程式为。
如KNO3溶液),则该反应的离子方程式为。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈
绿色,后者呈蓝色,某同学提出这可能是溶液中Cu2+与NO2共存的结果,请你设
计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水、生成Zn(NH3) 。回答下列问题:
。回答下列问题:
(1)铝的氢氧化物溶于盐酸的离子方程式为。
(2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____
①硫酸锌和氨水②硫酸铝和氨水
③硫酸锌和氢氧化钠④硫酸铝和氢氧化钠
(4)写出可溶性铝盐与氨水反应 的离子方程式
的离子方程式 。
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):
(1)工业电解M溶液的化学方程式为。
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是,写出A与B溶液反应的化学方程式是。
(3)若A是一种常见酸性氧化物,可用于制造光导纤维,则A元素原子结构示意图为
,写出E与F反应的离子方程式是。
(4)举例说明M物质的一种用途。
按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①Fe(Al)②NH3(H2O)
③NO(NO2)④NaCl溶液(Na2SO4)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末g。
②配制时应选用的仪器有500mL溶量瓶,托盘天平、烧杯、药匙、。
③若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥 处理 处理 |
| D.定容时府视刻度线 |
已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所 致,是溶液中引起的。
致,是溶液中引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案:。
假设2方案: 。
。
(2)根据高中所学的知识判断,你认为(填“假设1”或“假设2”)的推断是正确的;若选用淀粉—碘化钾溶液验证你的假设是否可行?(填“可行”或“不可行”),理由是。
(3)若向 稀溴化亚铁溶液中通入过量
稀溴化亚铁溶液中通入过量 氯气,反应的离子方程式为。
氯气,反应的离子方程式为。