在一定条件下,在密闭容器中进行的反应aX(g)+bY(g) cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少
cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少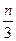 mol·L-1,Z增加
mol·L-1,Z增加 mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为( )
mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为( )
| A.1∶3∶1∶2 | B.3∶1∶2∶2 | C.3∶1∶2∶1 | D.1∶3∶2∶2 |
在一定温度下,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡的标志是
2NH3(g)达到平衡的标志是
| A.NH3的生成速率与NH3的分解速率相等 |
| B.单位时间内生成nmolN2的同时生成3nmolH2 |
| C.N2、H2、NH3的浓度不再发生变化 |
| D.N2、H2、NH3的物质的量之比为1:3:2 |
用铂(惰性)电极进行电解,下列说法中正确的是
| A.电解氯化钠溶液,在阴极析出钠 |
| B.电解熔融氯化镁制取镁时,阴极和阳极生成的产物物质的量之比为1:1 |
| C.电解稀硫酸,在阴极和阳极分别产生氧气和氢气 |
| D.电解熔融氧化铝过程中,若有3.01×1024个电子转移,则生成1mol铝 |
根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g)  2HI(g) △H = -9.48 kJ·mol-1
2HI(g) △H = -9.48 kJ·mol-1
(2) I2(s)+ H2(g)  2HI(g) △H =" +26.48" kJ·mol-1
2HI(g) △H =" +26.48" kJ·mol-1
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.40" mol·L-1·s-1
B.υ(C)="0.50" mol·L-1·s-1
C.υ(A)="0.30" mol·L-1·s-1
D.υ(B)="0.60" mol·L-1·s-1
甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流。关于此燃料电池的下列叙述正确的是
| A.通入CH 4的电极为正极 |
| B.正极的电极反应式为:2O2 +8e - +4H2O=8OH- |
| C.若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O 2被氧化 |
| D.通入甲烷的电极的电极反应式为:CH 4 +2O 2 + 4e - =CO 2+ 2H2O |