根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g)  2HI(g) △H = -9.48 kJ·mol-1
2HI(g) △H = -9.48 kJ·mol-1
(2) I2(s)+ H2(g)  2HI(g) △H =" +26.48" kJ·mol-1
2HI(g) △H =" +26.48" kJ·mol-1
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是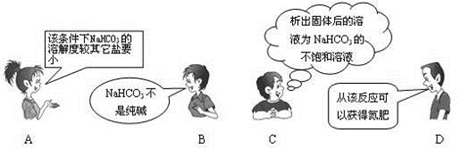
下列各组离子在溶液中能大量共存的是
| A.H+ , SiO32-, Na+ , Cl- |
| B.Fe3+ , Mg2+ , SCN-, SO42- |
| C.K+ , Ca2+ , CO32-, Cl- |
| D.Al3+, Fe2+ , NO3-, SO42- |
下列反应中,反应后固体物质增重的是
| A.氢气通过灼热的CuO粉末 |
| B.二氧化碳通过Na2O2粉末 |
| C.将锌粒投入Cu(NO3)2溶液 |
| D.碳酸氢钠固体加热至没有气体放出 |
下列物质在生产、生活和科技等方面的叙述不正确的是
| A.生铁、普通钢和不锈钢中的碳含量依次增加 |
| B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C.节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩 |
| D.明矾在自然水中生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
下列实验操作合理的是
| A.用稀硫酸清洗做焰色反应的铂丝 |
| B.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C.用100mL容量瓶配制50mL 0.1 mol·L-1的盐酸 |
| D.测NaOH熔点时可以将NaOH放入石英坩埚中高温熔化 |