下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==== +4 +4 +2H2O +2H2O |
B.澄清石灰水与少量苏打溶液混合:Ca2++OH-+ ====CaCO3↓+H2O ====CaCO3↓+H2O |
| C.碳酸钙溶于醋酸:CaCO3+2H+====Ca2++CO2↑+H2O |
| D.氯化亚铁溶液中通入氯气:2Fe2++Cl2====2Fe3++2Cl- |
在如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头管内盛放某种液体。挤压滴管的胶头,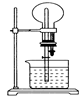
下列与实验事实不相符的是
| A.CO2(NaHCO3溶液)/无色喷泉 |
| B.NH3(H2O含酚酞)/红色喷泉 |
| C.H2S(CuSO4溶液)/黑色喷泉 |
| D.HCl(AgNO3溶液)/白色喷泉 |
下列制备气体的实验设计中错误的是
下列说法正确的是
| A.进行SO2性质探究实验时,多余的SO2应排到实验室外 |
| B.硫及其化合物通常存在于火山喷出的气体中 |
| C.SO2气体通入BaCl2溶液中不会产生白色沉淀 |
| D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 |
对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
| A.Br- | B.SO42— | C.H2SO3 | D.NH4+ |
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是
| 物质 |
NaCl |
AlF3 |
AlCl3 |
MgCl2 |
CO2 |
SiO2 |
| 熔点/℃ |
801 |
1291 |
190(2.5×105Pa) |
714 |
-56.5 |
1723 |
A.AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B.AlF3晶体的晶格能小于NaCl晶体的晶格能
C.同族元素的氧化物可以形成不同类型的晶体
D.不同族元素的氯化物可以形成相同类型的晶体