由铜片、锌片与200 mL硫酸组成的原电池中,若锌片只发生电化学腐蚀,则当在铜片上共放出0.15 mol气体时,H2SO4恰好全部用完。产生这些气体消耗锌多少克?所用硫酸的物质的量浓度是多少?
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问___(填“能”或“不能”)用
碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由:_
。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐使用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
有0.2mol的有机物和0.4mol的 在密闭容器中燃烧后的产物为
在密闭容器中燃烧后的产物为 、CO和
、CO和 (气),产物通过浓
(气),产物通过浓 后,质量增加10.8g,再通过灼热的CuO,充分反应后,氧化铜质量减轻了3.2g;最后气体再通过碱石灰完全吸收,质量增加17.6g。
后,质量增加10.8g,再通过灼热的CuO,充分反应后,氧化铜质量减轻了3.2g;最后气体再通过碱石灰完全吸收,质量增加17.6g。
(1)试推断该有机物的分子式。
(2)若0.2mol的该有机物恰好与9.2g的金属钠完全反应,则有机物的结构简式为;名称为。
将一定质量的Zn放入18mol/L的浓H2SO4中,充分反应后,共收集到标况下的气体4.48L,且1mol该气体的质量为48.5克。在反应后的溶液中,加入足量的BaCl2溶液,生成58.25克的沉淀。则求:
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
以CO、H2和CH2=CH2为原料,在钴催化剂作用下加压加热,可制取丙醛: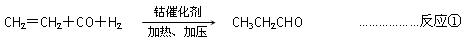
丙醛经反应②(加氢加成)可生成正丙醇、经反应③(催化氧化)可生成丙酸。由正丙醇和丙酸经反应④(酯化反应)生成丙酸正丙酯。请通过计算回答下列问题:
(1)理论上生产3.0kg正丙醇至少需要标准状况下的氢气L;
(2)由于副反应的发生,生产中反应①、反应②、反应③的产率分别为80%、80%、90%。若反应④中反应物转化率均为70%。则:
① 以2.8×103kg乙烯为原料,当反应②、反应③中丙醛的投料比为1∶1时,通过上述4步反应最多可制得丙酸正丙酯kg;
② 反应④中增加正丙醇的投料并保持正丙醇的转化率不变,可以使丙酸的转化率提高20%,此时反应②和反应③中丙醛的投料比应为多少?
已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子就是一个质子,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶入CS2
(1)请写出元素符号:B;C;
(2)画出E的阴离子结构示意图:;
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为
;
(4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L的NaOH溶液中,完
全吸收后,溶液中(除Na+外)浓度最大的离子是。