2005年10月12日我国用长征二号F型火箭成功发射了神舟“六号”载人飞船,并于10月17日圆满着陆。标志着我国载人航天又有新的突破。长征二号F型火箭用的燃料是液态的偏二甲基肼(C2H8N2),氧化剂是液态的N2O4,已知1.5 g火箭燃料偏二甲基肼完全燃烧生成氮气,二氧化碳和液态水放出热量50 kJ。下列说法不正确的是( )
| A.燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能 |
| B.偏二甲基肼在四氧化氮中的燃烧反应是放热反应 |
| C.该反应中偏二甲基肼和四氧化氮总能量小于二氧化碳、氮气和水的总能量 |
D.燃烧时的总反应为:C2H8N2+2N2O4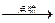 2CO2+3N2+4H2O 2CO2+3N2+4H2O |
甲型H1N1流感目前在世界范围内流行,达菲(Tamiflu)是目前世界上公认的治疗甲型H1N1流感的有效的药物,它是以莽草酸(shikimicacid)为原料合成的,已知莽草酸和达菲的结构式如下: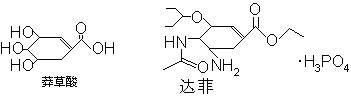
下列判断正确的是()
| A.莽草酸、达菲均属于芳香族化合物 |
| B.莽草酸、达菲均不能溶于水 |
| C.由莽草酸生产达菲的过程中发生了酯化反应 |
| D.莽草酸能发生加聚反应,但不能发生缩聚反应 |
现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,比较丙、丁活泼性
③用石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换丙单质判断甲、丙的活泼性
上述实验能达到目的的是()
| A.①④ | B.②③ | C.③ | D.④ |
将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒体积的一半处停止了,则剩余气体的成份是()
| A.NO2 | B.NO | C.O2 | D.NO或O2 |
除杂质时,为了保证杂质尽量被除去,加入的试剂必须稍过量,最后的过量物可以使用物理或化学方法除去。现要除去NaCl中少量的CaCl2、ZnCl2、Na2SO4杂质,下列选用试剂及其使用顺序正确的是()
| A.Na2CO3、BaCl2、HCl |
| B.BaCl2、Na2CO3、H2SO4 |
| C.BaCl2、Na2CO3、HCl |
| D.Ba(NO3)2、Na2CO3、HCl |
2009年11月13日,美国航天局宣布,月球坑观测和传感卫星获得的撞月数据显示,月球上存在“数量可观的水”。下列有关说法正确的是()
A.月球上的H2O分子中只含有非极性共价键
B.H2O在化学反应中既可作氧化剂又可作还原剂
C.氢的三种同位素H、D、T与16O只能形成三种水分子
D.在标准状况下,1mol水的体积约是22.4L