从结构推测有机物 最不可能具有的性质是( )
最不可能具有的性质是( )
| A.能发生取代反应 |
| B.能被新制Cu(OH)2氧化 |
| C.能加聚得高分子化合物 |
| D.能使溴水褪色 |
下列广告用语在科学上没有错误的是( )
| A.这种饮料中不含任何化学物质 |
| B.这种蒸馏水绝对纯净,其中不含任何离子 |
| C.这种口服液含丰富的氮、磷、锌等微量元素 |
| D.没有水就没有生命 |
长时间烧沸的天然水不宜喝的主要原因是( )
| A.水中的氧气少了 |
| B.水中的亚硝酸盐浓度大了 |
| C.水中的钙镁离子多了 |
| D.水中的二氧化碳多了 |
聚合氯化铝(PAC)通式为[Al2(OH)nCl6-n]m,是无机高分子混凝剂,它是用软铝矿(主要成分Al2O3·H2O)为原料制备,制备的最后一步反应是将Al(OH)3凝胶与[Al(OH)2(H2O)4]Cl按照一定配比恰好完全反应制得PAC,则该反应中前者与后者的物质的量之比为( )
A.1∶1 B. 
C. 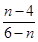 D.
D. 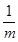
近科学研究表明,用氯气杀灭自来水中的病菌并非优良方法,氯胺(NH2Cl)在中性或酸性条件下是一种更好的强消毒剂。氯胺的消毒原理之一是( )
| A.NH2Cl+HCl===NH3↑+Cl2↑ |
| B.NH2Cl+H2ONH3+HClO |
C.NH2Cl===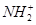 +Cl- +Cl- |
| D.NH2Cl+HClONH2ClO+HCl |
高铁酸钠(Na2FeO4)的氧化性比KMnO4还强,它易被还原成Fe3+,是一种值得推广的新型净水剂。下列关于用Na2FeO4作为净水剂的分析中,错误的是( )
| A.同物质的量相比,Na2FeO4的消毒效率是Cl2的1.5 倍 |
| B.该物质既能杀菌消毒,又能使水澄清净化 |
| C.该物质既能杀菌消毒,又能除去水中的Ca2+、Mg2+ |
| D.用该物质净水,不会引入对人体健康有害的物质 |