定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)="x" mol、n(H2)="y" mol、n(NH3)="z" mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是( )
| A.x : y ="1" : 3 |
| B.N2、H2的转化率不相等 |
| C.平衡时,H2与NH3的生成速率之比为3 : 2 |
| D.x的取值范围为0<x<0.14 |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是:H2A===H++HA-、HA-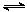 H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,不正确的是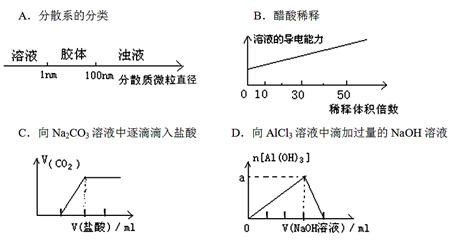
短周期元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl2溶液中②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
| A.①③④⑤ | B.只有①④ | C.只有②③ | D.只有③④⑤ |