2001年6月21日,河南的郑州、洛阳及南阳市率先使部分汽车采用封闭运行方式,试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,完成以下问题:
(1)乙醇的结构简式为_____________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5—C11范围内,如戊烷,其分子式为__________________,结构简式及其同分异构体分别为_____________、_____________、_____________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品,如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
①淀粉+水 葡萄糖(C6H12O6)
葡萄糖(C6H12O6)
②葡萄糖 乙醇
乙醇
(3)淀粉可由绿色植物经光合作用等一系列生物化学反应得到,即水和二氧化碳经光合作用生成葡萄糖,由葡萄糖再生成淀粉。进行光合作用的场所是_____________,发生光合作用生成葡萄糖的化学方程式是
__________________________________________________________。
(4)乙醇充分燃烧的产物为__________________和__________________。
(5)车用乙醇汽油称为环保燃料,其原因是__________________________________________。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、N H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水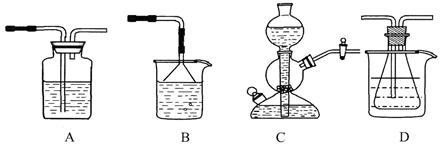
四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
| NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
| NH4Cl |
29.4 |
33.3 |
37.2[ 来源:Z|xx|k.Com] 来源:Z|xx|k.Com] |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是(填字母)。
(2)A装置中盛放的试剂是,其作用是。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去杂质(以化学式表示)
( 5)将锥形瓶中的产物过滤后,所得的母液中含有(以化学式表示),加入氯化氢,并进行操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有(以化学式表示),加入氯化氢,并进行操作,使NaCl溶液循环使用,同时可回收NH4C1。
(11分)某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠含量,采用如图所示装置。图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸。(据资料显示:Cl2与NaOH在不同温度下,产物不同。在较高温度下易生成NaClO3)
试回答:
(1)烧瓶B中盛________,试管C中盛________。
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置________(填“能”或“不能”),理由是
________________________________________________________________________;
②能否省去丙装置________(填“能”或“不能”),理由是
_____________________________________________________________________________________。
(3)有同学认为还必须添加某些装置,你认为怎样?________(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用是_______________________________________________。
(4)丁装置中冰水的作用是____________________________________________________________。
(9分)某无色待检溶液A中含有K+、Cl-、OH-、SO32-、SO42-,为检验确认其中所含的各阴离子,可选用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、高锰酸钾溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如图所示。
(1)图中试剂①④⑤的化学式分别为:①________,④________,⑤________。
(2)图中现象a、b、c表明检验出的离子分别是:a.________,b.________,c.________。
(3)无色溶液A中加试剂③的主要目的是_____________________________________
________________________________________________________________________。
(4)把白色沉淀A中加入的试剂②改为试剂③对实验的影响是___________________
________________________________________________________________________。
(9分)镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用__________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
________________________________________________________________________。
(3)试剂②可以选用________,其反应的离子方程式为_________________________
________________________________________________________________________。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式________________________________________________________________________
________________________________________________________________________。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为____mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为________L。
(8分)某课外小组利用H2还原黄色的WO3粉末来测定W的相对原子质量。下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题:
(1)仪器中装入的试剂:B________、C________、D________。
(2)连接好装置后应首先__________________________________________________,其方法是______________________________________________________________________________________________________________________________________。
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是
________________________________________________________________________。
在这两步之间还应进行的操作是___________________________________________
________________________________________________________________________。
(4)反应过程中G管逸出的气体是___________________________________________,
其处理方法是___________________________________________________________
________________________________________________________________________。
(5)从实验中测得了下列数据:
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知)。
计算式1:Ar(W)=________;计算式2:Ar(W)=________。