我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、N H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水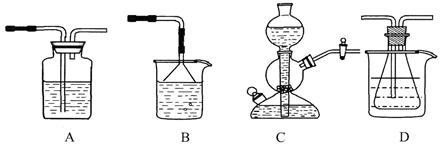
四种盐在不同温度下的溶解度(g/100g水)表
| |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
| NH4Cl |
29.4 |
33.3 |
37.2[ 来源:Z|xx|k.Com] 来源:Z|xx|k.Com] |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
( 5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd。请回答下列问题:
(1)上图装置2中应盛放溶液(写化学式)。
(2)为了使反应随开随用,随关随停,上图方框内应选用装置(填上图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行1装置的操作,待装置(填数字编号)中出现现象时,再点酒精 灯,这步操作的目的是
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为。
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2O和C:
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
||||
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 |
|
||||
| ⑤铝条与2mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
||||
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________________________。
(2)实验用品。仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
| 实验方案* |
实验现象* |
有关化学方程式 |
(4)实验结论:________________________________________________________。
(5)请从结构理论上简单说明具有上述结论的原因 。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律 。
(本题共14分)(每空2分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用( 选填序号)
a.KSCN溶液和氯水b.铁粉和KSCN溶液c.浓氨水 d.酸性KMnO4溶液
(3)分析上述(2)实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在 ,需在装置中添加M于(选填序号)。
,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q气体,预计实验现象是。
(7)如果气体Y中含有H2气体,预计实验现象是。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: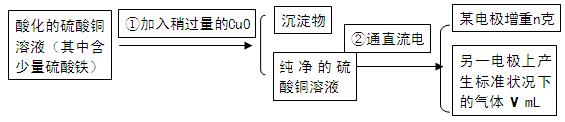
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如图所示,则A连直流电源的极(填“正”或“负”)。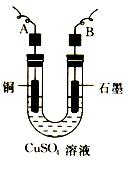
(3)电解开始后,在U形管中可以观察到的现象有:
电解的离子方程式(总反应)为
。
(4)下列实验操作中必要的是(填写字母)。
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
| D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行; |
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。