某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。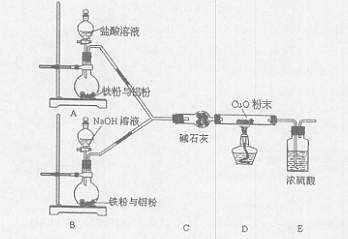
请回答:
(1)碱石灰的作用是 。
(2)下列操作进行的顺序由先到后的是 (填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性 ③点燃酒精灯
④装入药品 ⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式: 。
(4)写出装置A、B中实验现象的不同点 。
(5)该装置不够完善,还需增加的装置为 。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是 。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为 。
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据: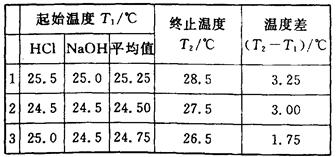
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
| A.溶液混合后未及时盖好量热计杯盖 |
| B.倾倒溶液太快,有少量溅出烧杯 |
| C.溶液混合后搅拌不够 |
| D.未等温度升到最高值就记录温度计示数 |
E.用量筒量取盐酸体积时仰视读数
F.烧杯和玻璃棒吸收了一部分热量
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。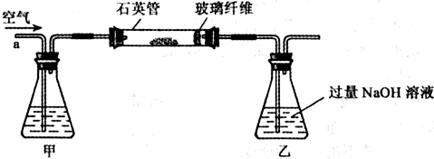
写出石英管中发生反应的化学方程式为:
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: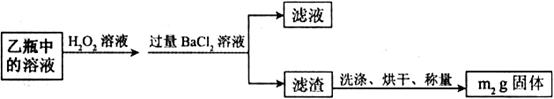
问题讨论:
(1)I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式有________________________、________________________。
(2)Ⅱ中,所加H2O2溶液需足量的理由是_______________________。
(3)该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]:设计以下实验方案测定铁元素的含量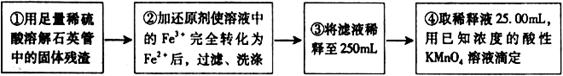
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 |
|
| ② |
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。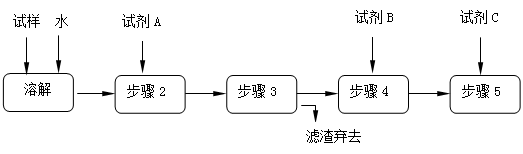
(1)溶解所需玻璃仪器是;步骤3的操作名称是
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有
假设3:氯化钠和氢氧化钠都含有
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是_______________________。
②填写下表:
| 实验步骤 |
预期现象和结论 |
| 步骤4: |
|
| 步骤5: |
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: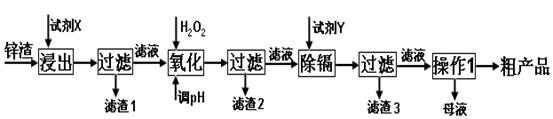
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。